鋰金屬基電池(LMBs)由于其高比容量(3860 mAh g-1)和低標準還原電位(相對于標準氫電極為-3.04 V),通常被認為是提高整體電池容量和能量密度的理想選擇。然而,鋰金屬電極受到鋰金屬的不均勻電化學沉積和溶解行為的挑戰。
此外,常規液態電解液的揮發性和易燃性也會引起安全問題。室溫離子液體(ILs)是熔融鹽,可用作各種類型電池有機溶劑的替代品,以解決液態電解液可燃性或揮發性有關的問題,并對Li的電化學溶解和沉積均勻性具有積極影響。
最近的研究強調了集流體-電解液相界處的電偶腐蝕現象。對于LMB,鋰金屬電極和集流體(通常是銅)或金屬電池外殼(通常是不銹鋼)之間的界面處,通過兩者與電解液的接觸,可以發生電流耦合。
在這種情況下,Li作為氧化電位較低的金屬可以被氧化,而在另一種金屬上則發生還原反應。對于Li和集流體,Li氧化產生的電子可以通過集流體轉移到與電解液的相界,從而發生還原性電解液分解反應。這種反應也會導致Li表面形成凹坑。
【成果簡介】
近日,德國明斯特大學Martin Winter、Peter Bieker將電偶腐蝕作為一種電化學分解過程,認為它是導致電池性能退化的因素。
為此,作者系統地研究了四種離子液體(IL)中Li與Cu、Ni或不銹鋼的電偶腐蝕行為,以及與IL中LiTFSI濃度的關系,這些ILs由TFSI?和具有四種不同環尺寸和烷基鏈長度的季銨陽離子(N-丁基-N-甲基吡咯烷(Pyr14+)、N-甲基-N-丙基吡咯烷(Pyr13+)、N-丁基-N-甲基哌啶(Pip14+)和正丁基三甲基銨(N1114+))組成。
通過頂空-氣相色譜-質譜聯用技術,對IL的分解產物進行了鑒定,并通過Li電沉積和溶解的庫侖效率(CE)和零電阻電流法(ZRA)分析了IL的分解程度。
基于這些發現,作者表明了更復雜的電極設計和電解液配方的必要性。相關成果以題為“Galvanic Couples in Ionic Liquid-Based Electrolyte Systems for Lithium Metal Batteries—An Overlooked Cause of Galvanic Corrosion?”發表在國際著名期刊Adv. Energy Mater.上。
【內容詳情】
導電材料對Li腐蝕的影響
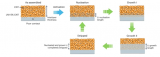
在這項研究中,將Li電極和不同導電材料組成電偶層并置于IL中,以模擬LMB中電偶的發生。在圖1中,在純N114TFSI中長時間浸泡后,不同材料組合的電偶層在Li表面形成凹坑。其中,Cu導致最明顯的Li表面劣化。
此外,僅在Li處觀察到點蝕形成,而未觀察到電偶金屬(Ni、Cu或不銹鋼)的形態變化。而對于使用非導電聚合物箔代替導電金屬的電偶層(boPET),Li表面沒有發生形態變化。因此,導致Li電極腐蝕的化學反應僅在具有導電材料的電偶層中發生,并且與Li接觸的材料的導電性會促進其進行。然而,如果在浸沒前向IL中添加足量的LiTFSI,則坑的形成會受到抑制。
ILs分解產物的鑒定
為進一步闡明在電偶腐蝕的反應途徑,利用頂空-氣相色譜-質譜(HS-GC-MS)分析了IL分解的氣體反應產物。圖2顯示了浸沒Cu||Li電偶層的IL分解產物的色譜圖。對于Pyr14TFSI和Pyr13TFSI,觀察到1-甲基吡咯烷是主要分解產物。
Hofmann消除烷基鏈的方法是由β位置的去質子作用引發。這使得Pyr14+和Pyr13+陽離子的相應丁基和丙基比甲基更易于消除,從而導致1-甲基吡咯烷作為這些陽離子的有利反應產物。對于以哌啶為基礎的Pip14+陽離子,觀察到了消除丁基的類似反應產物1-甲基哌啶(IIIa)。
N1114+陽離子的Hofmann消除產物是三甲胺。由于相對較大的分子量和反應性雙鍵,這些分解產物可作為形成聚合物或其他類型分解產物的潛在前體。聚合反應可能隨后導致凝膠狀殘留物,這種凝膠的形成會對電解液粘度和離子導電性產生負面影響,并最終導致電池劣化。
LiTFSI含量對電偶腐蝕的影響
進一步對腐蝕性反應進行定量評估以獲得最佳準確性。在圖3所示的HS-GC-MS試驗中,改變基于IL的電解液中LiTFSI的含量,并分析了由電腐蝕產生的氣態反應產物。如圖3a-d所示,四個ILs都顯示出烯烴分解產物。特別令人感興趣的是,對于四種ILs,當其中LiTFSI含量增加時,峰強度均降低,直到檢測不到任何烯烴的最高LiTFSI含量。
由于峰值強度依賴于分解產物的數量,因此可以得出結論:Li的電化腐蝕程度在很大程度上取決于ILs電解液中LiTFSI的濃度。在電化腐蝕過程中,來自Li的電子穿過電化學勢較高的金屬,并使金屬與電解液的界面發生反應。
因此,LiTFSI對電偶腐蝕的抑制可能是由于在Cu或Ni表面形成有效的絕緣界面層,或通過影響(例如,與干擾離子對或界面上形成雙層有關)引起的,但需要通過未來的研究進一步闡明。
ZRA法分析副反應程度
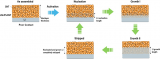
為模擬在具有Li基電極、集流體(Cu或Ni)和IL基電解液的LMB電池中發生的電偶腐蝕過程,對Cu||Li和Ni||Li電池進行了外部短路,并測量從Li到對電極的電流。該程序被稱為ZRA,已被證明有助于腐蝕現象的量化。在所有情況下,在ZRA實驗開始時,測量到幾毫安范圍內的初始電流,隨后,電流迅速下降,趨于穩定μA范圍(圖4)。
相對較高的初始電流不僅可以解釋為電偶腐蝕,也可以解釋為實驗開始過程中發生的其他自發電化學過程,如雙電層的形成或集流體表面氧化層的還原。然而,這些電流貢獻可以預期在短時間內(例如120 s)完成,在此之后,電偶腐蝕將成為整個測量腐蝕電流的主要貢獻因素。
在3天的測量期間,四種不同的ILs的腐蝕電流都遵循相似的模式,初始快速下降之后,收斂到高原狀區域(圖4)。進一步通過積分對應電流隨時間的變化,計算每個IL的總腐蝕電荷Q。結果表明,不同陽離子與金屬鋰的反應性受其化學結構的影響。
這種結構-性質關系是可以預期的,因為季銨離子的每個不同側基都有不同程度的消除反應。與無環體系相比,環取代基通常通過降低反應動力學來抑制消除反應。通過空間效應,增加烷基鏈取代基的長度可以略微降低消除反應的程度。
通過CE分析副反應程度
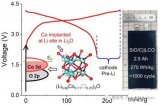
評估(腐蝕性)副反應程度的另一種方法是研究Li電沉積和溶解循環的CE。CE的值由電化學溶解的Li和先前電化學沉積的Li的比率來確定。因此,100%的值表示在沒有任何副作用的情況下的理想行為。
如圖5所示,對于Ni和Cu基體,在所有ILs中,CE均隨時間增加,從低至20%的值開始,在最初的幾個循環中逐漸增加,直到達到90%左右的穩定值。由于副反應產生的電子和鋰消耗水平較低,因此CE值較高。但此處所研究的電池在負極側上具有過量的Li。而對于實際應用的電池,力求使鋰含量最小化,因此期望避免副反應而導致的任何鋰損失。
電偶腐蝕機理
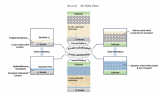
基于這項研究的結果,在還原消除反應期間,Li氧化產生的電子通過集流體轉移到季銨陽離子上,引發分解反應。Li的這種氧化可以認為是Li中形成凹坑的主要原因。
通過Li的電化學溶解實驗可知,Li表面的SEI層對離子具有導電性,但電子絕緣。因此,Li+可以通過表層進行傳輸,而電子電流只能通過集流體或者通常通過電耦合材料流向腐蝕性電解液。電偶腐蝕過程可在不施加外部電流的情況下發生,例如,在電池的儲存期間,從而引起對電池長期性能的影響。然而,這也表明,通過增加四種IL電解液中的LiTFSI含量,可以降低電偶腐蝕的程度。示意圖2 電偶腐蝕機制示意圖3 抑制電偶腐蝕的策略
【總結】研究表明,Li與Cu、Ni、甚至不銹鋼的電偶在ILs中會發生電偶腐蝕;即使無外加電流作用,Li表面也會形成凹坑。HS-GC-MS表明季銨陽離子會發生還原,其中一些分解產物可能進一步與凝膠狀或聚合物成分發生反應,從而加劇電池的退化。
此外,提出了一種用于定量分解的電化學方法組合,揭示了陽離子活性方面的明顯差異。非環季銨鹽N1114+離子的分解程度最高,可能是由于缺乏環的穩定性。對不同濃度的LiTFSI電解液中電偶反應性的比較表明,當存在一定的溶解閾值時,可以有效地抑制電偶腐蝕。
如果不避免集流體和電解液之間的接觸,則在實驗室或商用電池中可能會發生Li與另一種導電金屬的電偶。由于還可以觀察到不銹鋼和其他導電電池材料的電偶形成凹坑,因此電池中的電偶形成可能不僅限于集流體,而且可能發生在金屬電池外殼材料和其他材料中。
為避免離子液體電解液和其他電解液中電偶腐蝕過程引起的副反應,提出了以下對策:i)最小化導電材料(集流體和/或與金屬鋰接觸的金屬電池外殼部件)與電解液的界面面積;ii)使用足夠高的導電鹽濃度;iii)使用電解液添加劑,在鋰金屬和/或集流體上形成保護性表面層;iv)在將這些材料浸入電池之前,在鋰電極或集流體上涂覆保護性表面層。第一作者:Jan Frederik Dohmann通訊作者:Martin Winter、Peter Bieker通訊單位:德國明斯特大學
編輯:jq
-
電偶
+關注
關注
0文章
50瀏覽量
14895 -
電解液
+關注
關注
10文章
840瀏覽量
23067 -
鋰金屬電池
+關注
關注
0文章
134瀏覽量
4301
原文標題:一個造成鋰金屬電池性能退化卻被忽視的因素!
文章出處:【微信號:Recycle-Li-Battery,微信公眾號:鋰電聯盟會長】歡迎添加關注!文章轉載請注明出處。
發布評論請先 登錄
相關推薦
欣界能源發布“獵鷹”鋰金屬固態電池
CASAIM與北京工業大學合作開展鋼桁梁鋼材三維掃描試驗,研究高服役期鋼材銹蝕特征及力學性能退化規律






 一個極小卻被忽視造成鋰金屬電池性能退化的因素
一個極小卻被忽視造成鋰金屬電池性能退化的因素















評論