PD-1/PD-L1免疫檢驗點拮抗型抗體在腫瘤免疫治療領(lǐng)域取得突破性進展,近年來雙特異性抗體T細(xì)胞接合器(T Cell Engager)和靶向共刺激受體的激動型抗體迎來了開發(fā)的浪潮。然而,免疫激動型抗體的開發(fā)具有很大的挑戰(zhàn),需要綜合抗體親和力、表位、效價、簇形成、Fcγ受體相互作用、受體占用率等多方面的考慮。
生物科技支柱技術(shù)噬菌體展示技術(shù)巧妙的實現(xiàn)了蛋白表型和基因型的偶連,從而可以基于親和力對上億種分子進行高效篩選。激活型抗體的篩選只能依賴于對幾千個抗體逐個純化、表達和和檢測,因此藥物研發(fā)領(lǐng)域迫切需要開發(fā)一種高通量的激活型抗體篩選方法。
近日,南開大學(xué)張宏愷課題組與高誠生物醫(yī)藥有限公司、上海科技大學(xué)及上海交通大學(xué)合作在Science Advances期刊上發(fā)表題為High throughput functional screening for next generation cancer immunotherapy using droplet-based microfluidics的文章。

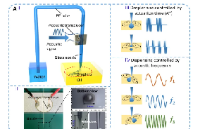
研究團隊開發(fā)了基于液滴微流控系統(tǒng)的高通量功能型抗體篩選技術(shù)(圖1),首先構(gòu)建慢病毒抗體文庫并用該文庫感染細(xì)胞,每個細(xì)胞僅被一個病毒感染從而每個細(xì)胞分泌一種抗體;之后通過液滴微流控系統(tǒng)將單個抗體分泌細(xì)胞與單個報告細(xì)胞共包裹在同一個微液滴中,每一個液滴相當(dāng)于一個獨立的微型反應(yīng)器,互不影響;細(xì)胞在液滴中培養(yǎng)后,通過熒光激活液滴分選(FADS)系統(tǒng),分選出含有激活報告細(xì)胞的液滴,液滴微流控系統(tǒng)可以在數(shù)小時實現(xiàn)對數(shù)百萬個液滴的生成和分選;隨后,從液滴中回收抗體分泌細(xì)胞、擴增并進行下一輪篩選;經(jīng)過多輪篩選后從富集細(xì)胞中提取抗體基因進行測序,從而確定活性抗體的序列。
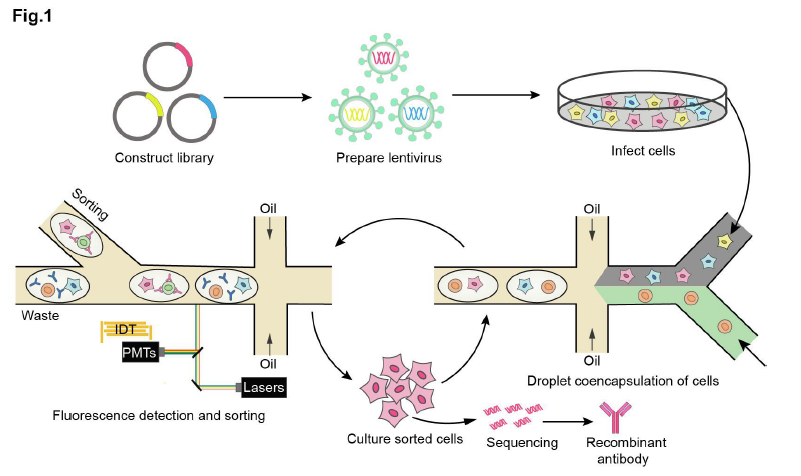
圖1 基于液滴微流控系統(tǒng)的高通量功能型抗體篩選技術(shù)流程圖
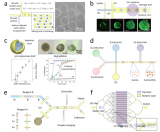
研究人員利用基于液滴微流控系統(tǒng)的高通量功能型抗體篩選技術(shù)篩選CD40受體的激動型抗體。經(jīng)過兩輪篩選后,研究人員對初始文庫和兩輪篩選后的抗體庫進行三代測序及生物信息學(xué)分析,發(fā)現(xiàn)一些抗體實現(xiàn)了逐輪的富集,對富集程度最高的5個抗體進行表達純化和驗證發(fā)現(xiàn)5個抗體都是CD40的強激動型抗體。研究人員利用該方法篩選出了初始頻率僅有0.02%的活性抗體,而初始文庫中比例很高的無活性抗體在篩選過程中被逐輪淘汰。值得一提的是,基于該平臺篩選出的CD40激動劑抗體C04,在小鼠模型中有效激活免疫系統(tǒng)并抑制腫瘤生長,未經(jīng)任何優(yōu)化的C04抗體的安全性和有效性均媲美臨床試驗中的CD40激動型抗體CP870893。另外,研究人員利用該方法經(jīng)過一輪篩選即獲得多個anti-Her2×anti-CD3雙特異性抗體T細(xì)胞接合器。
該論文報道了一種基于液滴微流控系統(tǒng)的高通量功能型抗體篩選方法,有效實現(xiàn)了基因型和活性表型的耦合,使得從百萬種多樣性的抗體中快速篩選活性抗體成為可能,且節(jié)約了人力和資金的投入,將能夠促進下一代腫瘤免疫療法藥物的開發(fā)。同時,該研究范式將能夠應(yīng)用于多肽和細(xì)胞因子改造、細(xì)胞間通訊和TCR與新生抗原配對等多方面的研究。
南開大學(xué)助理研究員王媛博士和博士生晉瑞娜為論文共同第一作者,高誠生物沈冰清博士和上海科技大學(xué)王瑋博士做出了關(guān)鍵貢獻。
責(zé)任編輯:lq
-
檢測
+關(guān)注
關(guān)注
5文章
4440瀏覽量
91376 -
反應(yīng)器
+關(guān)注
關(guān)注
2文章
95瀏覽量
11029 -
微流控
+關(guān)注
關(guān)注
16文章
512瀏覽量
18863
原文標(biāo)題:液滴微流控系統(tǒng)加速雙抗及激動型抗體等新一代腫瘤免疫抗體的開發(fā)
文章出處:【微信號:Micro-Fluidics,微信公眾號:微流控】歡迎添加關(guān)注!文章轉(zhuǎn)載請注明出處。
發(fā)布評論請先 登錄
相關(guān)推薦
高通量生物分析技術(shù)之微流控芯片
S型微流控芯片的優(yōu)勢
深視智能高速攝像機在液滴微控流實驗中的應(yīng)用

微流控芯片在生物學(xué)有何應(yīng)用?微流控芯片微液滴、檢測技術(shù)介紹
基于軌道電潤濕的液滴操控技術(shù),有望用于新一代數(shù)字微流控平臺

一種用于微液滴中單細(xì)胞無標(biāo)記分析的液滴篩選(LSDS)方法
高通量測序技術(shù)及原理介紹
功率放大器應(yīng)用領(lǐng)域分享:基于液滴微流控的線粒體轉(zhuǎn)移新技術(shù)
微流控柱陣列裝置中微小液滴的形成原理介紹

基于液-固摩擦電納米發(fā)電機的微流控芯片,用于微液滴參數(shù)的無創(chuàng)自動力監(jiān)測




 一種基于液滴微流控系統(tǒng)的高通量功能型抗體篩選方法
一種基于液滴微流控系統(tǒng)的高通量功能型抗體篩選方法










評論