循環腫瘤細胞(CTC)是指一組從原發性腫瘤分離并在血液中循環的稀有癌細胞。大量證據表明,CTC是標記癌癥轉移進展的關鍵生物標志物。相關研究已發現外周血中CTC的數量與總生存期(OS)相關,可被視為癌癥進展的指標。因此,準確識別和計數CTC在癌癥診斷和有效監測中具有重要意義。
目前,分析CTC的一個主要障礙是它們相對于大量血細胞而言極為稀有。近年來,基于明場顯微成像的細胞形態鑒定和分類方法因具有簡單、無標記和易于獲取的優點,在CTC鑒定中表現出極大的應用前景。然而,目前用于CTC鑒定的顯微鏡形態學方法主要依賴于載玻片上細胞的靜止成像,由于通量的限制,通過“靜止成像”方法測量的血細胞數量不足以檢測數量稀有的CTC。
據麥姆斯咨詢報道,來自鄭州大學楊瀟楠教授課題組與中科院微電子所張文昌副研究員課題組聯合提出了一種明場成像細胞術(BFIC)技術,以及多幀圖像關聯(MFIC)算法,作為一種潛在的無標記CTC識別和計數方法。這種方法可以在連續記錄寬微流控通道中流動細胞圖像的同時確定細胞類型,并可以很容易地與大多數現有的CTC富集方法相結合,使其成為具有潛力的液體活檢樣本無標記分析工具。相關研究成果以“Label-free detection and enumeration of rare circulating tumor cells by bright-field image cytometry and multi-frame image correlation analysis”為題發表于Lab on a chip期刊,其中碩士生杜自強和鄭大一附院李婭副主任醫師、陳冰助理研究員為論文共同第一作者,張文昌副研究員和楊瀟楠教授為共同通信作者。
為了實現高檢測通量和檢測精度,研究人員提出了BFIC(圖1),并設計了一種具有長直通道(400μm × 30μm × 600μm)的微流控器件來引導細胞以層流方式通過。由于400μm的通道寬度遠大于腫瘤細胞的大小,因此細胞可以平行通過,與單通道方法相比,可實現更高的通量和無堵塞操作,其吞吐量可高達每分鐘5萬個細胞,如果使用更高速度的相機、更大的視野可以進一步提高吞吐量。
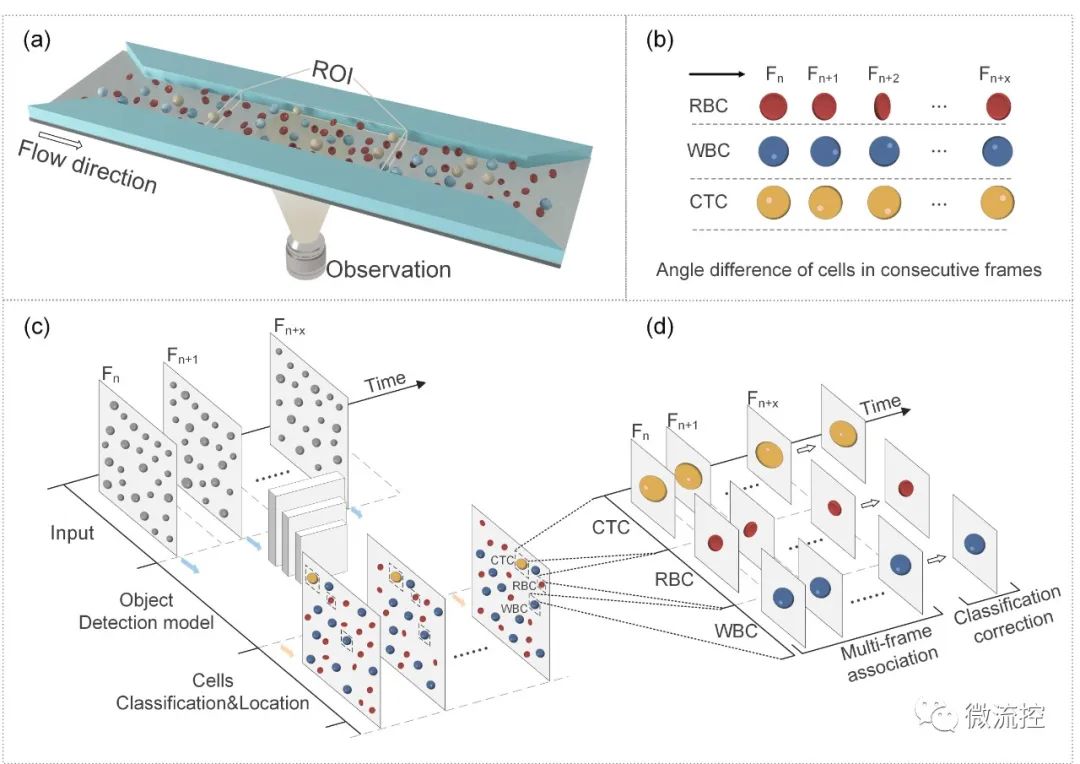
圖1 (a)明場成像細胞儀示意圖;(b)連續幀中細胞的運動狀態;(c)連續單幀中的細胞分類和定位;(d)多幀關聯和計數。
采集到的圖像被傳輸到計算機上經過訓練的神經網絡YOLO-V4,結合每一幀的細胞類型和位置以及幀序列信息,得出細胞的初步分類決策(圖1(c))。接著,研究人員通過執行基于細胞跟蹤的MFIC算法以提高檢測精度,如圖1(d)所示。根據YOLO-V4模型給出的細胞類型和坐標信息,在細胞跟蹤算法下將細胞的多幀檢測結果關聯起來。
在具體試驗過程中,為了對該方法進行測試,研究人員選擇了三種類型的細胞系,包括結直腸腺癌細胞系的HT29、肺癌細胞系的A549和食管癌細胞系的KYSE30。獲得的紅細胞(RBCs)、白細胞(WBCs)和腫瘤細胞的圖像如圖2所示。
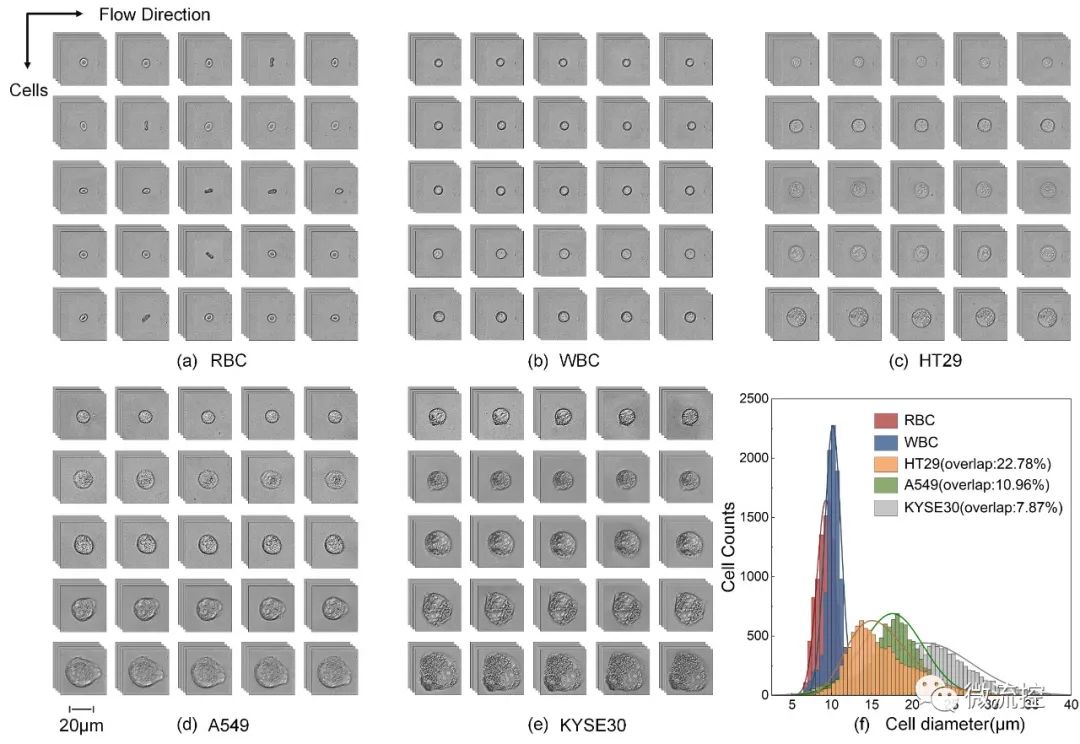
圖2 (a-e)RBCs(a)、WBCs(b)、HT29(c)、A549(d)和KYSE30(e)的細胞圖像,比例尺:20μm;(f)檢測細胞的尺寸分布。
經過訓練,細胞檢測模型能夠給出分類決策以及位置坐標。測試集上每一幀細胞的匯總結果如表1和表2所示。從表2可以看出,對于上述三種腫瘤細胞,單幀檢測的平均精度(AP)可以分別達到98.63%、99.04%和98.95%。
表1 測試集的混淆矩陣
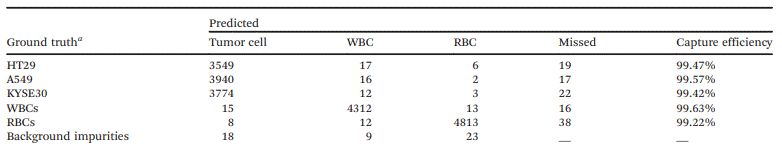
表2 YOLO-V4單幀檢測在測試集上的性能評價
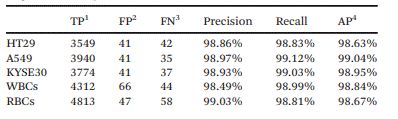
此外,為了定量比較單幀檢測與多幀相關檢測在識別效果方面的差異,研究人員采用了隨機單幀模式和連續5幀模式檢測每個細胞系的500個腫瘤細胞。如圖3(c)所示,連續幀中CTC的識別主要表現在以下三種情況:True——CTC在每一幀中都被正確識別;False——非CTC(背景或其他細胞)被錯誤識別為CTC,表現出假陽性;Loss——CTC因在單個幀(例如WBC)中的錯誤識別或因細胞粘附而漏檢而表現出假陰性。
在獲得每一幀的所有細胞類型后,為了模擬單幀的檢測結果(傳統的靜態細胞檢測),研究人員隨機地選擇每個細胞連續5幀中的一幀,匯總了500個細胞的隨機單幀結果后,得到一個“單幀AP值”。每個“單幀AP值”代表在單幀模式下執行一次CTC檢測。這個過程重復了100次。圖3(d)、(f)和(h)分別顯示了100次隨機試驗中HT29、A549和KYSE30的“單幀AP值”分布。
而在多幀數據關聯中,單個腫瘤細胞在連續幀中被正確識別的次數記為n(1≤n≤5)。然后,研究人員使用不同的n作為閾值,對跟蹤的腫瘤細胞進行二次分類決策,作為多幀檢測結果。之后,參考AP的計算方法,研究人員計算了多幀關聯中不同閾值下的分類結果的AP。圖4(e)、(g)和(i)顯示了n值對三個細胞系AP值的影響。當閾值n取非端點值時,多幀檢測的AP與單幀檢測的平均AP相比有顯著提高。
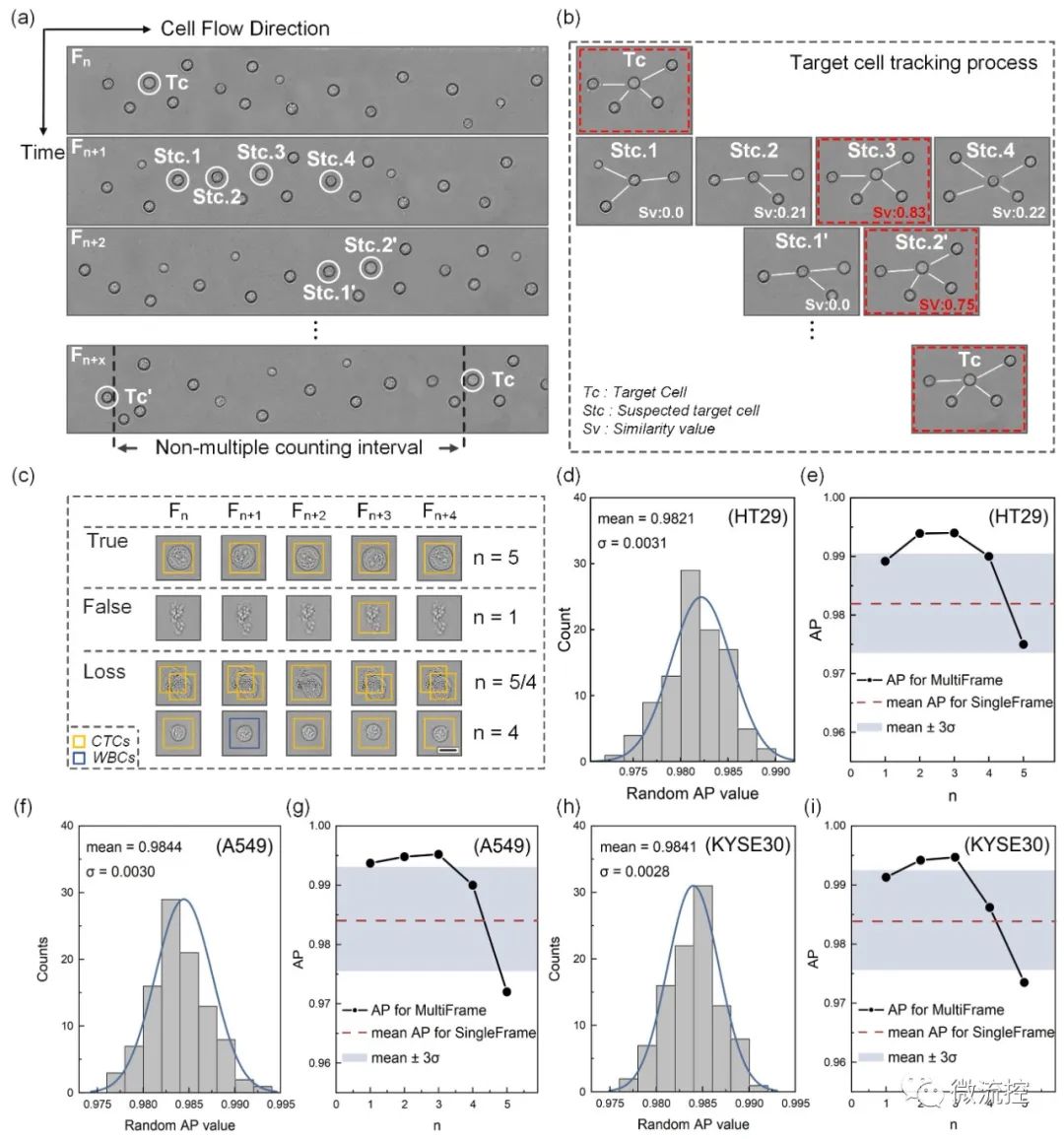
圖3 (a)連續幀的細胞圖像;(b)目標細胞從Fn到Fn+x跟蹤過程示意圖;(c)連續幀中的CTC識別案例;(d)、(f)和(h)100次隨機試驗中三種腫瘤細胞的“單幀AP值”分布;(e)、(g)和(i)閾值n對多幀關聯分析模式下三種腫瘤細胞AP值的影響。
大多數可用的CTC檢測技術依賴于CTC標記物的標記,例如上皮細胞粘附分子(EpCAM)和E-鈣黏蛋白(E-cadherin)。然而,這些上皮生物標志物在上皮-間質轉化(EMT)過程中會急劇減少,并會導致標記信號的丟失。為了評估EMT對上述CTC檢測方法的影響,研究人員利用HT29細胞系對EMT前后的腫瘤細胞進行了檢測。圖4(d)和(e)的數據表明,基于明場動態顯微成像與多幀關聯算法的無標記循環腫瘤細胞檢測方法在EMT后對CTC的平均識別精度為98.8%。因此,與依賴細胞表面特異性抗原表達的基于標記的檢測技術相比,該無標記檢測方法具有很大的優勢,突破了僅適用于對上皮來源的CTC篩選的局限性。
圖4 (a)PMA誘導的HT29細胞形態和分子表達變化;(b)通過蛋白質印跡分析評估E-鈣粘蛋白和N-鈣粘蛋白的表達;(c)HT29(EMT后)懸浮成像示意圖;(d)HT29(EMT后)在100次隨機試驗中的AP分布柱狀圖;(e)多幀關聯模式下不同閾值下的AP分布。
最后,為了評估該檢測系統的性能,研究人員評估了其檢測限(LoD)。圖5(a)顯示了通過該細胞計數法檢測到的樣品中HT29細胞數與顯微鏡檢測到的HT29細胞數之間的關系。值得注意的是,該系統檢測到的HT29細胞與顯微鏡檢查之間存在極好的線性關系(R2>0.99)。這種一致性驗證了該方法量化真實樣本中CTC數量的能力。同時,在HT29的比例低至0.01%左右時,曲線的線性度明顯下降。因而該方法的檢測限為每10萬個WBC檢測出10個CTC。
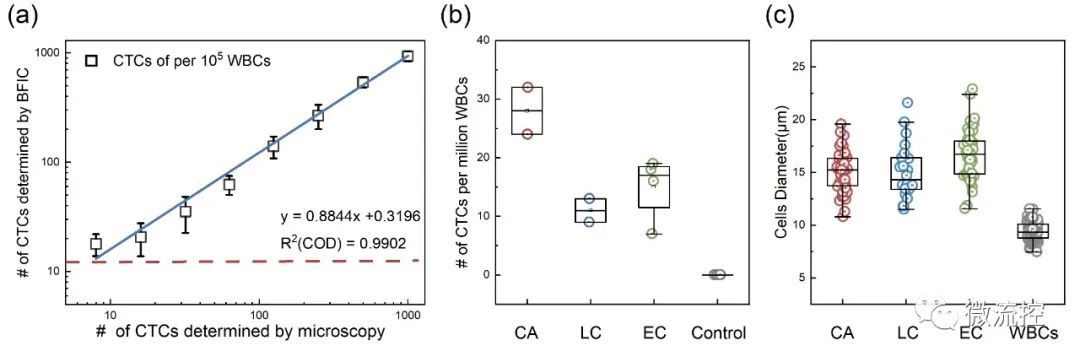
圖5 (a)BFIC得到的檢出限示意圖;(b)從2例結直腸腺癌(CA)患者樣本、2例肺癌(LC)患者樣本、4例食管癌(EC)患者樣本和6例健康供體(對照)樣本中檢出的CTC數量;(c)患者樣本中CTC和WBC的細胞直徑。
綜上所述,在這項研究中,研究人員引入了一種基于明場動態顯微成像與多幀關聯算法的無標記循環腫瘤細胞檢測方法。通過記錄微流控芯片中寬通道內的細胞圖像,并通過深度神經網絡確定細胞類型,達到了50000個細胞/分鐘的檢測通量,并避免了通道的堵塞。通過多幀相關分析,糾正了單幀中錯誤或遺漏的細胞分類結果,在不同種類的腫瘤細胞系(HT29、A549、KYSE30)的檢測中分別達到了高達99.40%、99.52%以及99.47%的AP。該檢測方法能夠較容易地從10萬個白細胞中檢測到多達10個腫瘤細胞,并且不受EMT的影響。另外,該方法也在8例癌癥患者的血液樣品中完成了驗證,具有良好的臨床應用潛力。
論文鏈接:
https://doi.org/10.1039/D2LC00190J
審核編輯 :李倩
-
成像
+關注
關注
2文章
223瀏覽量
30375 -
微流控
+關注
關注
15文章
480瀏覽量
18783
原文標題:基于明場動態顯微成像與多幀關聯算法的無標記循環腫瘤細胞檢測方法
文章出處:【微信號:Micro-Fluidics,微信公眾號:微流控】歡迎添加關注!文章轉載請注明出處。
發布評論請先 登錄
相關推薦
一種新穎的超快3D成像技術
一種無透鏡成像的新方法
流式細胞術: OEM 激光引擎帶來諸多優勢
聲光偏轉器(AODF)在高速熒光成像中的關鍵作用:FIRE技術簡介

用于流式細胞術的新型紫外激光器
“鬼成像”原理你知道嗎?

機器視覺成像:明場像與暗場像都有什么區別呢
一種多平面低相干衍射成像技術




 一種明場成像細胞術(BFIC)技術
一種明場成像細胞術(BFIC)技術












評論