液體活檢是確定癌癥發(fā)生發(fā)展的關(guān)鍵性技術(shù),有助于提前預防癌癥的發(fā)生或轉(zhuǎn)移。基于細胞外囊泡(EV)的液體活檢已經(jīng)成為癌癥檢測中的新興技術(shù)。然而,其應(yīng)用存在眾多障礙,如無法有效收集足夠EV用于分析生物學功能的變化,無法有效定性其源組織。此外,由于缺乏有效的生物標記物,EV的分離技術(shù)也有所受限。如果能夠提升基于EV的腫瘤檢測性能,將有效解決臨床中腫瘤的早期篩查等困難。
基于此,來自加拿大瑞爾森大學(Ryerson University)的譚波教授團隊開發(fā)了一種納米工程化的3D傳感器,由納米尺度探針實現(xiàn)自功能化的表面增強拉曼散射(SERS)技術(shù),對三種難以檢測的癌癥——乳腺癌、肺癌和結(jié)直腸癌具有100%的敏感性和100%的特異性,能夠準確的將癌癥與非癌癥樣本區(qū)分開來。相關(guān)工作以“Cancer Stem Cell Derived Extracellular Vesicles with Self-Functionalized 3D Nanosensor for Real-Time Cancer Diagnosis: Eliminating the Roadblocks in Liquid Biopsy”為題于近期發(fā)表在ACS Nano期刊。
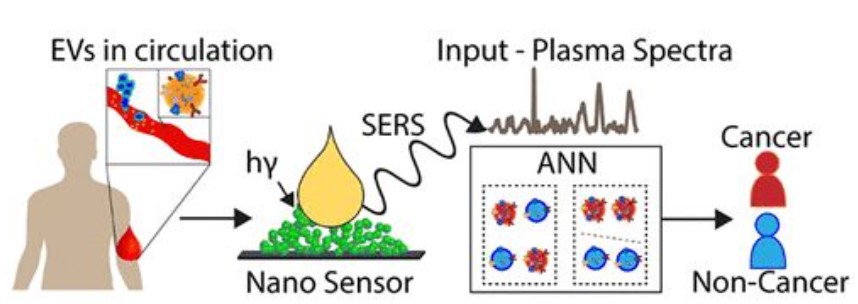
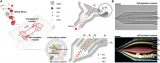
圖1 3D納米傳感器的構(gòu)造及其用于癌癥的檢測
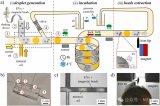
研究人員利用超快飛秒激光的多光子電離機制制備了納米傳感器。通過將鈦樣品暴露在離子輻射下,生成自組裝的納米探針網(wǎng)絡(luò),制備了三種類型的納米傳感器。通過控制激光刻蝕深度和激光脈沖的峰值功率來控制納米傳感器的特性,并進一步用分析物(羅丹明6G;R6G)測試納米傳感器的SERS信號放大效率。R6G的SERS光譜顯示了顯著增強的特征峰。相比沒有納米傳感器的R6G,納米傳感器1上的R6G的增強程度最高(約1000倍)。使用FDTD模擬求解麥克斯韋方程在鈦基納米探針周圍的區(qū)域。散射光強度的增強與電場增強的四次冪成正比,場增強的存在產(chǎn)生了局域表面等離子體。此外,研究人員使用了三個激發(fā)波長分析了電荷轉(zhuǎn)移機制的影響及其對波長的依賴。R6G的非完全對稱模式在三個激發(fā)波長上的選擇性放大證實了電荷轉(zhuǎn)移的存在。鈦的折射率為~2.61,TiO?的折射率為~2.1,空氣的折射率為1.61。三種材料折射率的對比可以產(chǎn)生全內(nèi)反射,除了在多層功能化納米探針中捕獲光子外,這還大大增強了拉曼信號隨著氧空位的存在,整體SERS水平顯著提高。與低氧空位的傳感器(納米傳感器2和3)相比,具有最高氧空位的納米傳感器(納米傳感器1)有效提高了約1000倍的SERS。此外,氧空位可以豐富表面態(tài),放大分析物和表面相互作用,一定程度誘導癌癥納米傳感器的拉曼信號顯著改善。
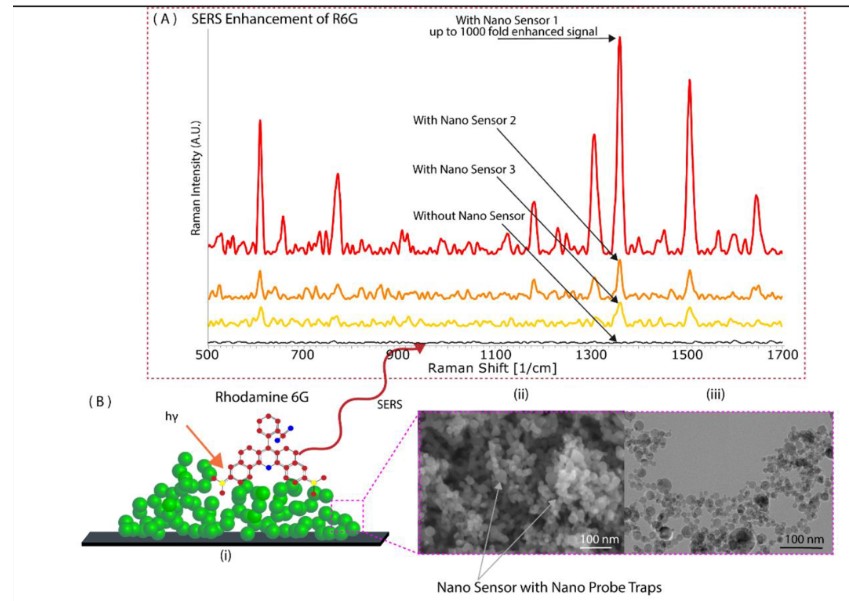
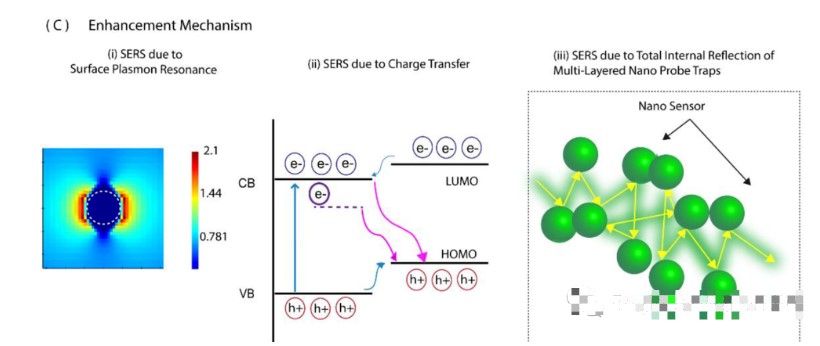
圖2 基于腫瘤納米探針的SERS技術(shù)。
(A)納米傳感器對羅丹明6G的SERS光譜顯示,其拉曼信號增強高達1000倍。與其他傳感器相比,最小尺寸和最高氧空位的納米傳感器(納米傳感器1)表現(xiàn)出最高的信號增強。(B)納米傳感器平臺上羅丹明6G的示意圖。(C)顯著增強信號歸因于多種現(xiàn)象的激活:(i)FDTD模擬表明存在SPR;(ii)極小尺寸相關(guān)的電荷轉(zhuǎn)移機制和氧空位的存在是納米傳感器顯著SERS響應(yīng)的原因;(iii)由于納米傳感器三維網(wǎng)絡(luò)的存在而產(chǎn)生的內(nèi)部全反射。
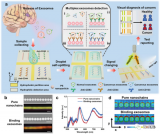
研究人員對來自三種乳腺、肺和結(jié)腸CSC的EV進行納米傳感器輔助SERS譜分析。PCA結(jié)果顯示PC評分存在顯著差異。PC1、PC2和PC3演示了三個單獨的簇。特征峰強度被繪制在熱圖中,以可視化觀察EVs內(nèi)容物的差異。然后將PCA得到的特征(拉曼峰)應(yīng)用于未經(jīng)處理的患者等離子體光譜,進行了兩種類型的分析。
首先,將一個組織起源與所有其他起源進行分類。基于ANN的分類具有100%的敏感性、100%的特異性、100%的準確性和100%的精度。同時,對乳腺癌達到了100%的敏感性和68%的特異性;結(jié)直腸癌的敏感性為36%,特異性為100%;肺癌的敏感性為99%,特異性為100%。觀察到大腸癌患者的血漿與乳腺癌有非常高的相似性。
因此,對于大腸癌,二分分類會更合適。這些結(jié)果表明,納米傳感器的能力可以準確識別組織來源。為了證實CSC EV對起源組織檢測的適用性,研究人員利用PLSDA建立的訓練模型進行補充分析,實現(xiàn)了73%的乳腺癌敏感性,42%的大腸癌敏感性和100%的肺癌診斷敏感性。乳腺癌的特異性為88%,大腸癌的特異性為100%,肺癌的特異性為70%。
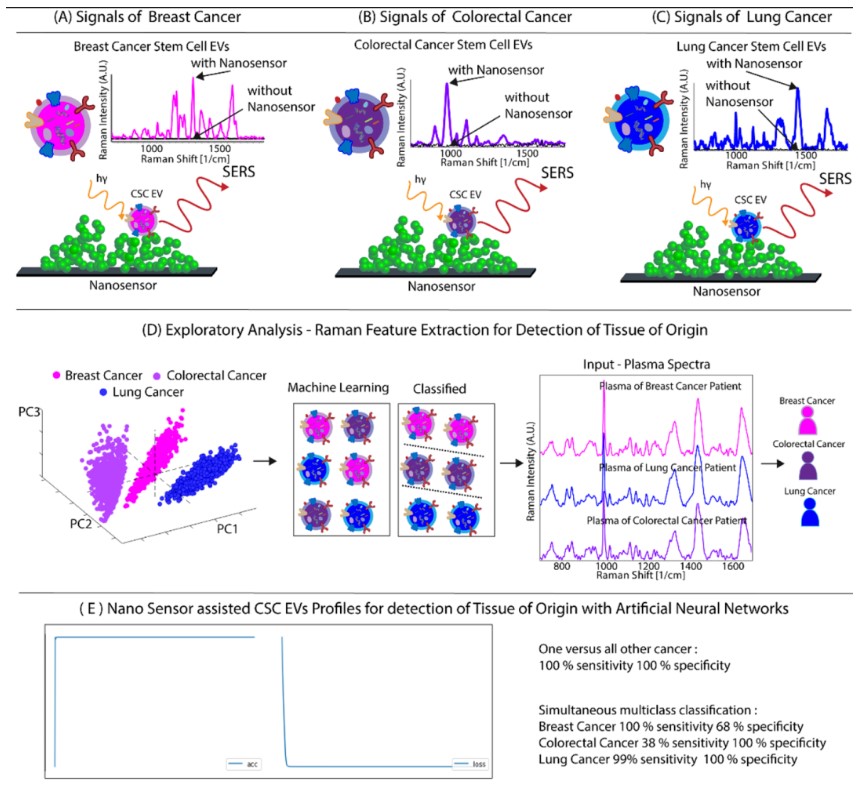
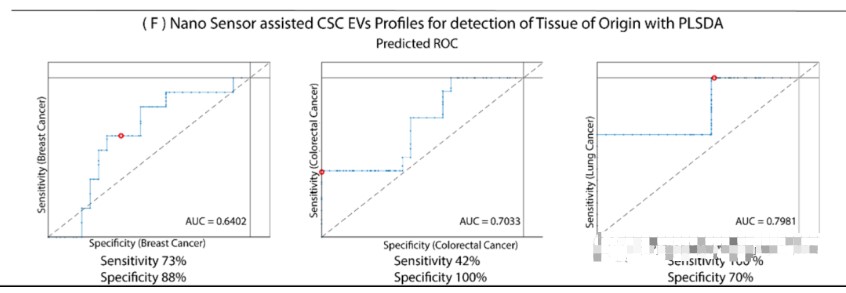
圖3 CSC EV鑒定源組織。
(A)乳腺癌信號來自于乳腺CSC EV的拉曼譜。(B)從結(jié)直腸癌CSC EV的拉曼譜獲得的結(jié)直腸癌信號。(C)肺癌的信號來自肺CSC的EV的拉曼譜。(D)乳腺癌、肺癌和結(jié)直腸癌的CSC EVs PCA顯示CSC EVs聚類,源組織鑒定示意圖。(E)將PCA特征應(yīng)用于患者血漿樣本。起源組織與所有其他組織的二元分類達到了100%的準確性。同時多類分類準確率達79%。(F)采用PLSDA分析對方法學進行驗證,證明診斷具有很高的敏感性和特異性。
總而言之,由于一些生物學和技術(shù)上的挑戰(zhàn),例如無法同時獲得EV內(nèi)多個分子的分子信息,現(xiàn)有的基于EV的液體活檢臨床可用性非常有限。
此外,現(xiàn)有的EV液體活檢不能識別組織的起源。研究人員通過對CSC EV的分子和功能信息的研究,消除了現(xiàn)有液體活檢的局限性。采用這種液體活檢工具,可以提高EV傳感器相互作用效率,可同時檢測多個EV的信號,通過實驗證明了CSC EV信號的利用對液體活檢是至關(guān)重要的。
對于三種難以檢測的癌癥(乳腺癌、肺癌和結(jié)直腸癌),人工神經(jīng)網(wǎng)絡(luò)以100%的敏感性和100%的特異性區(qū)分癌癥和非癌癥。基于ANN的二元分類將一個組織的起源與所有其他組織區(qū)分準確率100%,同時對所有三種不同類型的組織來源進行鑒定,患者血漿樣本的準確率達到79%。證明了技術(shù)的臨床可用性。如果在未來得到大量臨床樣本的驗證,這種模式可能會作為一種無創(chuàng)工具來補充現(xiàn)有的診斷工作流程以及縱向治療監(jiān)測。
審核編輯:劉清
-
傳感器
+關(guān)注
關(guān)注
2541文章
49979瀏覽量
747667 -
FDTD
+關(guān)注
關(guān)注
9文章
46瀏覽量
16673 -
激光脈沖
+關(guān)注
關(guān)注
0文章
83瀏覽量
10247
原文標題:基于自功能化3D納米傳感器的細胞外囊泡,用于實時癌癥診斷
文章出處:【微信號:Micro-Fluidics,微信公眾號:微流控】歡迎添加關(guān)注!文章轉(zhuǎn)載請注明出處。
發(fā)布評論請先 登錄
相關(guān)推薦
夏普宣布將開展EV業(yè)務(wù)
激光焊接技術(shù)在焊接醫(yī)療熱活檢鉗的工藝應(yīng)用

激光焊接技術(shù)在焊接醫(yī)療活檢針的工藝應(yīng)用

球囊擴張導管疲勞試驗儀儀器評估

激光焊接技術(shù)在焊接活檢鉗工藝的優(yōu)勢
超聲波消泡的原理與特點

激光焊接機在焊接活檢鉗的技術(shù)應(yīng)用

南京牧鐳激光用激光雷達感知風速風向,一煤礦故意封堵傳感器 ,3人被刑拘
美國研究人員使用干細胞制作芯片心臟,助力藥物安全性評估
ev電機的工作原理是什么
一種用于富集循環(huán)腫瘤細胞的螺旋微流控芯片設(shè)計

醫(yī)療初創(chuàng)企業(yè)使用 AI 分析癌細胞,在切取病理之后快速得出活檢結(jié)果
利用粘彈性微流控系統(tǒng),直接從人體血液中分離小細胞外囊泡




 基于細胞外囊泡(EV)的液體活檢技術(shù)
基于細胞外囊泡(EV)的液體活檢技術(shù)










評論