與疾病發生發展密切相關的低豐度生物標志物的超靈敏、多指標檢測是生物醫學領域的重大需求,但目前常用的檢測技術往往無法在單管檢測中同時實現多重生物標志物的精準鑒別和高靈敏檢測。新興的基于隔離分區模式的數字式生物檢測平臺雖能達到超高的檢測靈敏度,但受限于熒光檢測通道的數量與鑒別目標分子的編碼方式,無論是核酸樣本還是蛋白樣本,單管反應中檢測的目標分子種類均不超過10重。因此,如何在單管多重指標鑒別的同時實現超高靈敏檢測是目前生物檢測領域中極具挑戰的瓶頸問題。
據麥姆斯咨詢報道,針對上述亟待突破的關鍵問題,上海交通大學生物醫學工程學院古宏晨/徐宏團隊聚焦可快速生成無限量分區的高通量液滴微流控平臺,采用團隊獨創的編碼微球載體,構建了新型“編碼微球-液滴”基微流控芯片,并在此基礎上發展了“蛋白-核酸”通用型超靈敏數字式生物檢測技術。創新地實現了:(1)單個液滴對單個編碼微球的裝載率突破傳統“泊松分布”的限制,極大提高了數字式生物檢測的分析效率與檢測通量;(2)多重蛋白和核酸分子在編碼微球載體表面的單分子高效捕獲、“單微球-單分子”待檢編碼信號的準確鑒別、單分子靶標信號放大與單分子檢測。
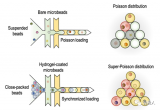
高效單編碼微球封裝的液滴微流控系統
在傳統的液滴分區中,利用熒光編碼微球作為鑒別、捕獲靶分子的載體,雖可大幅提高檢測重數與通量,但受限于泊松分布,液滴分區對單個微球的封裝完全隨機,通常僅有10%以下的分區為含有1個編碼微球的有效液滴,90%的液滴為未封裝編碼微球的空液滴。這些冗余的空液滴會在后續的檢測分析中造成分析資源的大量浪費。因此,基于“編碼微球-液滴”的多重數字式檢測方法學需要解決的首要問題是如何突破泊松分布的限制,讓有且僅有一個編碼微球的液滴分區比例大幅提高。針對此問題,該團隊提出了一種集微球排列、液滴生成與微球包裹的集成式“編碼微球-液滴”微流控芯片(bead ordered arrangement droplet system,BOAD)系統。首先利用巧妙的流體結構設計,在短至1cm的微流道中實現微球的快速有序排列,進而將有序排列的微球一一封裝入液滴。研究結果顯示,BOAD系統可將包裹有單個編碼微球的液滴分區比例大幅提升至86%,單個微球的封裝效率是常規檢測體系的9倍。進一步地,該研究還展示了54重編碼微球的高效包裹與精準解碼。最后,采用IL-10為模式待測分子,證明了構建的BOAD系統可實現超靈敏的數字式檢測,檢測靈敏度較傳統流式免疫熒光提高500倍。上述結果均展示了BOAD系統在多重數字式超敏檢測與單細胞分析等領域的強大應用潛力。
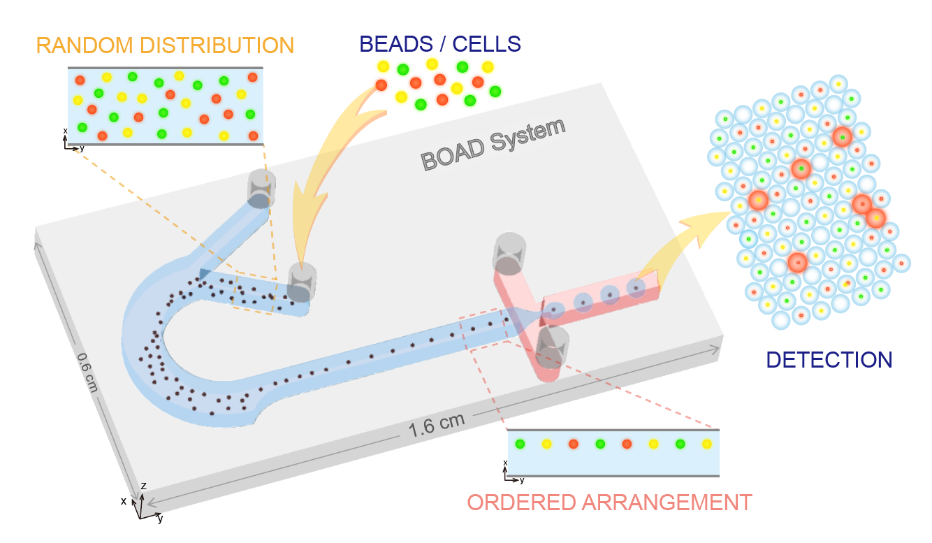
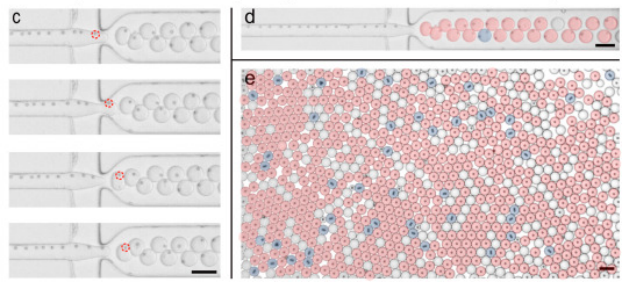
圖1 課題組提出的高效單微球封裝的液滴微流控系統
“編碼微球-液滴”基多重數字ELISA超敏檢測系統
靈敏度到亞fM級別(fg/mL)的超靈敏、多重數字酶聯免疫吸附(enzyme linked immunosorbent assay,ELISA)檢測技術在基礎生命科學研究和臨床應用等方面(如腫瘤早篩、阿爾茲海默病血液基標志物的檢測等)都具有重要的意義。該團隊基于液滴微流控平臺,以自主設計開發的新型熒光編碼微球作為識別不同蛋白分子的載體,創新性地開發了一種兼具通用性與實用性的多重數字ELISA技術。首先,針對如何在直徑幾十微米的pL級液滴中實現直徑僅幾微米的編碼微球精準解碼難題,團隊提出采用短、長曝光時間的二次成像方法,顯著提高編碼微球在液滴中的解碼精度,為超高重蛋白分子的多重數字式檢測提供可靠的檢測平臺。其次,針對pL液滴的單分子信號準確、快速檢出問題,采用酶信號放大單元作為酶標記物,快速實現單個待測分子的信號放大,僅需5min即可實現“1”和“0”液滴的區分與準確計數,顯著縮短檢測時間。最后,以TNF-α、IL-6、IFN-γ、IL-17A、IL-10等5種細胞因子為模式待測分子,在構建的“編碼微球-液滴”微流控芯片上成功實現了單管多重蛋白的數字式檢測,檢測靈敏度較傳統的多重懸浮芯片技術提升了100+~10000+倍。該工作證明了“編碼微球-液滴”基微流控技術有望成為臨床超敏蛋白檢測新的解決方案。
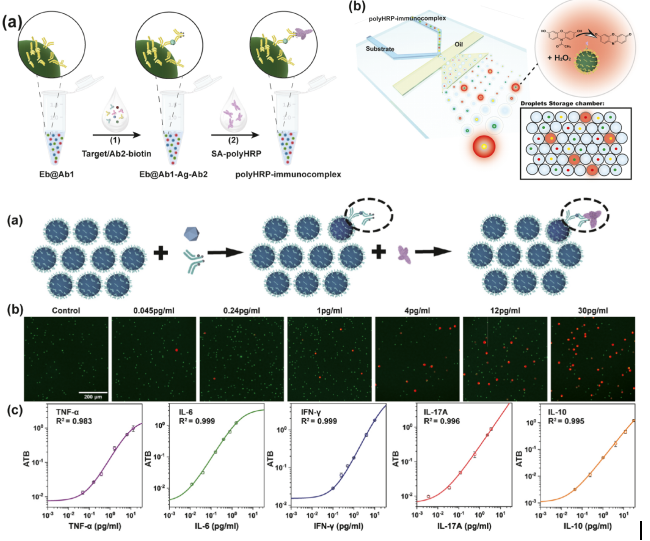
圖2 “編碼微球-液滴”基多重數字ELISA超敏檢測系統
“編碼微球-液滴”基多重數字PCR檢測系統
多重數字聚合酶鏈式反應(polymerase chain reaction,PCR)受到臨床應用與基礎生命科學研究等領域的日益關注。然而,當前的多重數字PCR技術缺乏兼具高靈敏度、高信噪比和超高多重靶標同時檢測的有效策略。基于此,該團隊提出了一種基于熒光編碼微球的液滴基多重數字PCR超敏檢測方法(Bead-based multiplexed droplet digital PCR)。該方法采用團隊自主研發的超高編碼容量熒光編碼微球作為不同核酸的鑒別載體,從而大幅提升檢測重數;進而結合通用引物與通用探針序列的巧妙設計,在“編碼微球-液滴”微流控平臺上實現高信噪比、超靈敏的多重核酸檢測。在該方法中,以新型冠狀病毒相關的orf1ab和N基因、甲型流感、乙型流感各自保守區基因以及陽控質粒作為模式待測靶標,通過預富集在不同靶基因上分別引入完全相同的通用序列;再利用固定有特異性探針的熒光編碼微球,對富集后的不同核酸分子進行單分子特異性捕獲,形成“單個編碼微球-單個核酸分子”雜交復合物;最后,將上述微球雜交復合物包裹進含有通用擴增引物和通用熒光水解探針的液滴中,進行單反應多重數字PCR檢測。該方法在流感病毒和新型冠狀病毒的五重聯檢中可實現接近單分子級別的檢測靈敏度,信噪比高且無交叉反應,為超高重數和超靈敏度的多重數字PCR技術奠定了基礎,具有實際臨床應用的潛力。
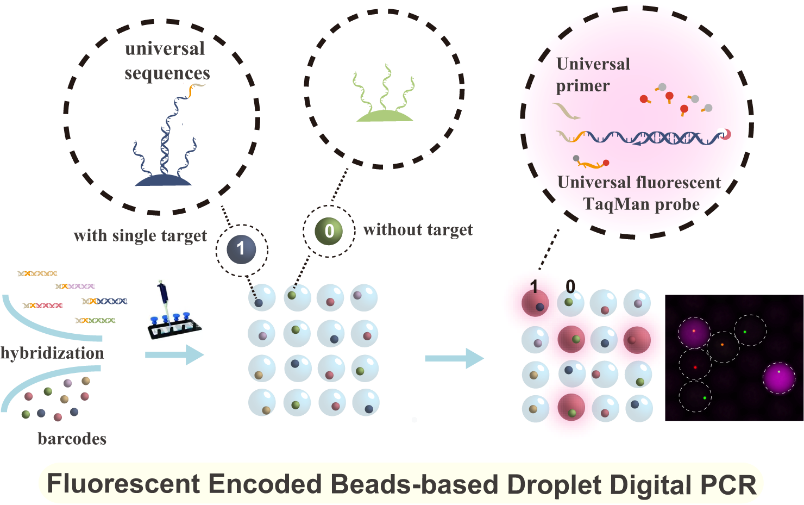
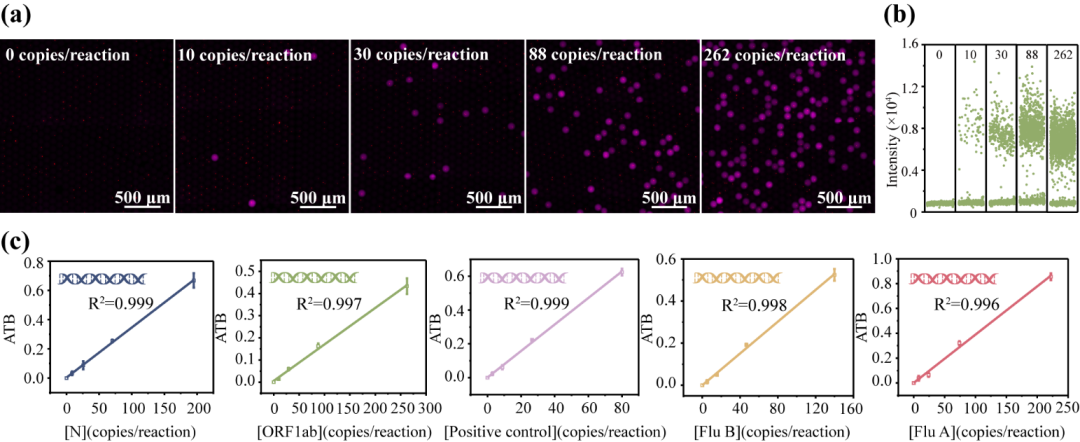
圖3 “編碼微球-液滴”基多重數字PCR檢測系統
-
封裝
+關注
關注
126文章
7784瀏覽量
142724 -
編碼
+關注
關注
6文章
935瀏覽量
54764 -
微流控系統
+關注
關注
1文章
66瀏覽量
1862
原文標題:基于“編碼微球-液滴”的微流控芯片,實現多重超靈敏數字式檢測
文章出處:【微信號:Micro-Fluidics,微信公眾號:微流控】歡迎添加關注!文章轉載請注明出處。
發布評論請先 登錄
相關推薦




 基于高效單編碼微球封裝的液滴微流控系統
基于高效單編碼微球封裝的液滴微流控系統












評論