【摘要】
本工作從基本燃燒元素的角度對硫化物SE的熱穩定性能進行了驗證,系統地研究了典型硫化物SEs(Li3PS4, Li7P3S11, Li6PS5Cl, LSPSCl, Li4SnS4)和具有不同脫鋰狀態的氧化物陰極Li1–xCoO2的熱力學和動力學特性。
【研究背景】
電動汽車和儲能站日益增多的火災事故嚴重制約了能量密度更高、安全性更好的鋰離子電池的發展。最終消除此類風險的最佳途徑是在材料層面提高電池的安全性,用不易燃/易揮發的固體電解質(SE),包括聚合物、氧化物和硫化物,取代易燃易揮發的有機液體電解質(LEs)。
然而,由于其優良的性能和常識的干擾,SE和固態電池的安全性一直被忽視。對于固體聚合物電解質(SPEs),其熱穩定性主要受聚合物單體和鋰鹽的特性影響,而其與電極材料的熱穩定性則與它們的種類和電極材料的狀態相關。作者團隊回顧了最近關于SPEs及其與陰極材料的熱穩定性的報告。
結果表明,SPEs的分解溫度在200到400℃之間,而它們與陰極材料的熱反應溫度相對較低,在150-350℃之間。對于氧化物SEs,盡管其合成溫度較高,但在與電極材料接觸時仍表現出明顯的放熱行為,這可能導致電池的熱失控。
2017年,Mukai等人設計了一種特殊的差示掃描量熱法(DSC)測試電池,發現全固態電池(ASSB)在初始溫度范圍為200-300℃時仍有放熱行為,這與陰極釋放的氧氣有關。同年,Kang小組發現Li1.5Al0.5Ge1.5(PO4)3(LAGP)和金屬鋰在加熱到200℃時,即使在惰性氣氛(Ar)中也會經歷劇烈的燃燒。
他們認為,在這個反應中會釋放出氧氣,從而進一步加劇化學反應。Li小組對四種典型的氧化物SE與金屬鋰的熱穩定性進行了系統研究,其順序為LAGP
上述報告表明,并非所有的SE都是絕對熱穩定的,特別的考慮到它們與電極材料的界面穩定性。 與聚合物和氧化物SEs相比,硫化物SEs與電極有良好的界面接觸,具有理想的可加工性,以及較高的室溫離子傳導率。然而,關于硫化物SEs/ASSBs的熱穩定性的研究很少被報道,因為它們對儀器有很強的腐蝕性,對測試環境的要求很高,在空氣/水中不穩定,而且容易釋放有毒氣體(例如,H2S,SO2)。
盡管如此,作者團隊通過建立合適的理論模型和參數,系統地研究了典型硫化物SE的熱穩定性,并揭示了典型硫化物SE的熱穩定性順序為Li6PS5Cl > Li4SnS4> Li9.54Si1.74P1.44S11.7Cl0.3(LSPSCl) > Li3PS4> Li7P3S11。由于LIB的陰極材料通常具有高氧化電位,硫化物SE和氧化物陰極材料之間的熱穩定性應該引起更多的關注。
Tsukasaki等人研究了75Li2S-25P2S5玻璃電解質(LPS)-LiNi1/3Mn1/3Co1/3O2(NMC)界面在高溫下的演變過程。結果顯示,LPS在150-175℃的溫度范圍內明顯收縮,在DSC中出現了復合陰極在帶電狀態下的明顯放熱過程。此外,Tsukasaki等人還發現,在400℃時出現了雜質Li4P2S6和Li2S,LPS玻璃電解質被氧化成Li3PO4,同時在400℃以上形成了MnS和CoNi2S4等雜質。
更多的實驗結果表明,陰極分解過程中釋放的氧氣會進一步加劇放熱反應過程。此外,通過類似的實驗還研究了Li4SnS4-NMC的熱穩定性,顯示出比LPS-NMC更高的初始放熱溫度。然而,目前只研究了少量的硫化物SE,沒有考慮硫化物SE的自我分解、熱化學反應的熱力學和動力學因素以及有效的改進方法。
因此,硫化物ASSBs的安全評估一直無法有效開展,這大大限制了其工業發展和大規模應用。
基于以上問題,近日,中科院物理所吳凡研究員團隊詳細研究了硫化物SEs的可燃性以及ASSB中典型硫化物SEs與電極材料之間的熱化學反應,從不同角度揭示了硫化物SEs的可燃性以及其與電極材料之間存在的嚴重放熱反應。作者通過設計一個直接/間接接觸的熱處理系統,發現硫化物SEs和Li1–xCoO2在400-500℃下發生反應。
系統地研究了硫化物SEs的熱穩定性、空氣穩定性和分解產物對上述反應過程的影響,同時發現硫化物SEs的分解產物在反應過程中起到了重要作用。隨著Li1–xCoO2脫鋰程度的加深,硫化物SEs的空氣穩定性在上述化學過程中的影響將逐漸突出。
基于一系列熱化學反應的基本數據,通過基辛格法(Kissinger)得到了硫化物SEs和Li1–xCoO2化學反應的關鍵動力學參數。此外,它們的熱化學反應主要可以分為兩個階段,即起始反應過程和劇烈反應過程。
發現不同的硫化物SE和Li1–xCoO2,在動力學參數上存在明顯的差異。有了上述對熱穩定性的認識,采用涂層和真空系統成功地抑制了硫化物SEs和Li1–xCoO2之間的熱化學反應,從而獲得了優異的電化學性能。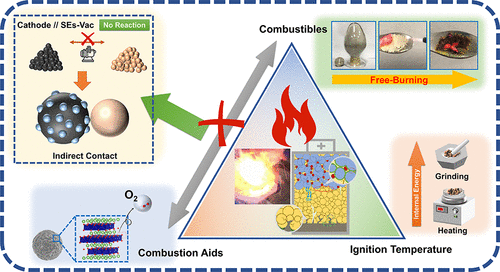
【研究內容】
硫化物SE及其電池材料的可燃性 電池的熱安全風險主要是指由電池內部嚴重的化學反應引起的熱失控。因此,對關鍵材料的熱穩定性及其界面熱反應的研究,有利于避免熱失控和提高熱安全性。熱失控本質上是一個燃燒過程,為此需要三個條件(也稱為 "燃燒三角",如圖1a所示),即助燃劑、可燃物和著火溫度。助燃劑一般是氧化性物質,在氧化還原反應中獲得電子,而可燃物一般是還原性物質,在廣義上的氧化還原反應中失去電子。
當環境溫度達到燃點時,可燃物和助燃劑直接接觸后將發生氧化-還原反應。這個過程會釋放出大量的熱量,使反應繼續激烈發生,最終導致燃燒和更嚴重的放熱反應。結論是,只有當這三個必要條件同時得到滿足時,才能發生燃燒或熱反應。從溫度的角度來看,很難防止 "燃燒三角 "的條件,因為較低的環境溫度通常會影響電池的性能,而且由于相變內熱材料的導熱性差,防止劇烈的熱擴散的效果并不理想。
在LIB中,盡管可以通過隔膜或其他絕緣層來防止陰極(助燃劑)和陽極(可燃物)的直接接觸,但由于LEs的揮發性、可燃性和熱穩定性差,接觸的風險仍然存在。因此,有望通過用SE取代LE來解決上述熱失控問題。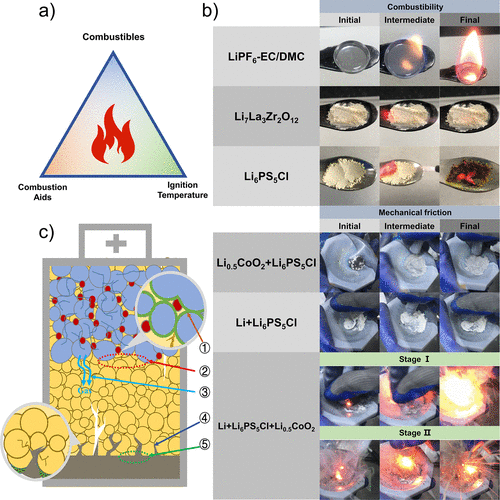
圖1.硫化物SE及其電池材料的可燃性實驗。(a) 燃燒三角形的示意圖,即引起燃燒的三個必要因素。(b) 硫化物SE及其電池材料的電解質可燃性和機械研磨燃燒的實驗照片。
其中,上部為1M LiPF6EC/DMC(v/v = 1:1)LE、Li7La3Zr2O12氧化物SE、Li6PS5Cl 硫化物SE在空氣中的點燃實驗。下部顯示了Li6PS5Cl + Li0.5CoO2,Li6PS5Cl + Li,以及Li6PS5Cl + Li + Li0.5CoO2在Ar中的研磨燃燒實驗。(c)可能導致ASSB熱失控的內部因素示意圖。
然而,SE的可燃性很少被報道,特別的具有高離子傳導性的硫化物SE。這是因為硫化物SEs與表征設施嚴重反應,產生有毒氣體(H2S,SO2),導致嚴重的腐蝕和環境污染。作者團隊通過建立內在的理論熱力學范式/模型和證實實驗證據,系統地研究了典型硫化物SE的熱穩定性。結果表明,硫化物SEs在加熱過程中會分解并釋放出揮發性/可燃性硫。
這充分表明,在硫化物ASSB的熱失控過程中或在其他適當的條件下,硫化物SE可以燃燒。圖1b顯示了1M LiPF6EC/DMC(v/v = 1:1)LE、Li7La3Zr2O12氧化物SE和Li6PS5Cl 硫化物SE在空氣中的加熱燃燒實驗。實驗照片顯示,1M LiPF6EC/DMC(v/v = 1:1)LE在空氣中容易燃燒,其燃燒火焰明顯且呈圓錐形。
這說明EC/DMC溶劑容易揮發,形成錐形火焰。Li7La3Zr2O12氧化物SE的形態在加熱后沒有變化,加熱過程中也沒有火焰產生。這一現象說明Li7La3Zr2O12氧化物SE在空氣中是不可燃的,并且具有良好的熱穩定性。最典型的硫化物SE,Li6PS5Cl,在加熱過程中產生小火焰,沒有明顯的煙霧,顯示出暗紅色的火花,逐漸擴散和燃燒。
可以得出結論,Li6PS5Cl在空氣中也是可燃的,但在加熱/燃燒過程中沒有產生明顯的揮發性/可燃性成分,這與我們小組以前報告的實驗結果一致。通過上述燃燒實驗,可以推斷出硫化物ASSB具有一定的熱安全風險,特別的在高環境溫度或內部溫度下。
電池內部的高溫通常是由不同的電極材料直接接觸引發的內部短路引起的。機械研磨在一定程度上像加熱一樣增加了材料的內能,而內能是由機械能轉化而來的。為了方便手套箱內的熱處理實驗,避免連續加熱過程中的污染或反應,采用機械研磨作為反應激發方式,代替傳統的平板加熱。
值得注意的是,機械研磨法不能有效量化,手工研磨的機械能比高溫加熱的機械能低得多。為了模擬Li-Li6PS5Cl-LiCoO2電池的熱失控過程,在Ar中Li6PS5Cl、Li和Li0.5CoO2電池材料之間進行了機械研磨燃燒實驗(圖1b)。在這樣的混合物中,Li6PS5Cl在以前的實驗中表現出一定的還原性和可燃性,而具有強氧化能力的Li0.5CoO2可以作為燃燒助劑。
然而,通過直接接觸的機械研磨,在Li6PS5Cl和Li0.5CoO2之間沒有觀察到燃燒現象,說明沒有發生氧化還原或燃燒反應。根據燃燒三角形,這可能是由低于燃點的低環境溫度造成的。Li6PS5Cl和Li的研磨也顯示沒有燃燒,有助于形成含有Li2S、LiCl和P的穩定界面,防止后續反應。值得注意的是,并不是所有的硫化物SE在與金屬鋰/活性陽極直接接觸后,在惰性氣氛條件下都不發生經過驗證的燃燒現象。
其他一些硫化物SE可能與金屬鋰發生嚴重的燃燒反應。Li3PS4會與金屬鋰反應產生嚴重的燃燒現象,而Li6PS5Cl卻沒有。實驗結果表明,不同的硫化SE與金屬鋰之間的燃燒現象有明顯不同。
然而,當Li6PS5Cl、Li和Li0.5CoO2電池材料混合研磨后,出現了明顯的燃燒現象,類似于電池的內部短路燃燒。陰極和陽極直接接觸釋放的大量熱量引發了Li6PS5Cl和電極材料之間的進一步連鎖反應。根據反應強度和火焰形態,整個燃燒過程可以分為兩個階段。
第一階段從零星的火花開始到明顯的燃燒火焰,并伴有煙霧,隨后第二階段從小火焰到爆炸性的放射性濺射燃燒,并伴有明顯的灰塵。可以推斷,由電極材料直接接觸引起的化學反應所釋放的熱量將進一步加劇硫化物SE的燃燒反應。此外,可能導致ASSB熱失控的內部因素如圖1c所示,包括:①陰極材料顆粒與SE顆粒的接觸反應;②正極與SE層的接觸界面反應;③陰極材料釋放的氧化性氣體;④負極的鋰枝晶的生長;⑤負極與SE層的接觸界面反應。在這些因素中,陰極和SE的關系對ASSB的整體熱穩定性起著至關重要的作用。
總之,硫化物SE本身具有還原性和可燃性,會導致嚴重的放熱反應。當它與Li0.5CoO2和陽極材料Li混合時,容易發生劇烈的燃燒。因此,考慮到在高溫下硫化物SE和陰極材料之間可能發生放熱反應甚至燃燒,即使在完全惰性的氣氛中,硫化物ASSB也不是絕對的熱安全。
因此,研究硫化物SE和陰極材料之間的熱穩定性是必要的,而且具有實際意義,這有利于深入分析ASSB的熱安全性。 典型硫化物SE和鈷酸鋰之間的熱穩定性 以前的工作詳細報道了硫化物SE在加熱過程中會發生不同的分解反應,其起始溫度遠遠低于氧化物SE的溫度。
例如,Li7P3S11在大約300℃時顯示出明顯的硫沉淀,并有初步的分解產物(Li3PS4,Li2PS3,和S)。分解產物Li3PS4將進一步分解為Li2S和S,這幾乎是所有硫化物SE的常見反應產物。Li2S和S都有很強的還原性和可燃性。在一定溫度下,這些分解產物可能直接與Li1–xCoO2接觸,并導致放熱反應或燃燒。
為了研究這一過程,將這些硫化物SE(Li2S/S)和LiCoO2的分解產物密封在石英管中,并加熱到設定的溫度(圖2a)。混合粉末的顏色隨著溫度的升高而逐漸加深,表明這些分解產物和LiCoO2之間發生了一些反應。此外,根據顏色的變化和石英管的腐蝕情況,它們在S和LiCoO2之間的反應似乎比Li2S的反應更激烈。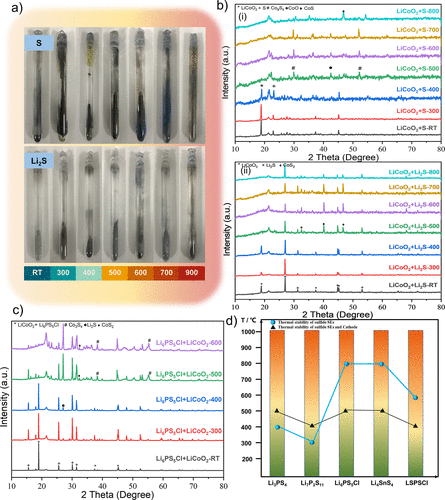
圖2.硫化物SEs和LiCoO2之間的熱穩定性實驗。(a) 硫化物SEs(S/Li2S)和LiCoO2的主要分解產物之間的加熱反應的實驗照片。(b) (i和ii)加熱上述混合粉末后的產品的XRD圖譜。(c) 在不同溫度下加熱Li6PS5Cl + LiCoO2混合粉末得到的產品的XRD圖譜。(d) 典型的硫化物SE(如Li3PS4, Li6PS5Cl, Li7P3S11, Li4SnS4, LSPSCl)和硫化物SE + LiCoO2的混合粉末的熱穩定性。藍色球體指的是硫化物SE的熱穩定性,黑色三角形指的是硫化物SE和LiCoO2之間的熱穩定性。
為了進一步確定分解產物(Li2S/S)和LiCoO2之間的氧化還原反應的熱力學反應產物,通過X射線衍射(XRD)對其產物的相分析進行了表征(圖2b)。圖2b-i顯示了S和LiCoO2的反應產物的XRD圖譜。在300℃以下沒有發現其他物質的衍射峰,表明在這個溫度范圍內LiCoO2和S之間沒有反應。當溫度上升到400℃時,LiCoO2的主峰強度明顯下降,這與結晶性差的S的衍射峰強度非常接近。
因此,LiCoO2和S的化學反應的起始溫度可能在400℃左右。當溫度達到500-700℃時,LiCoO2的主峰完全消失,雜質峰(Co9S8,CoO和CoS)逐漸加強。當溫度上升到800℃時,CoS峰變得突出,表明部分CoO與S進一步反應,形成CoS。從XRD圖譜可以得出結論,S和LiCoO2在300-400℃開始反應,主要的反應產物是Co9S8,CoO和CoS。
圖2b-ii顯示了Li2S和LiCoO2的反應產物的XRD圖譜。與S + LiCoO2的反應不同,Li2S在400℃以下沒有與LiCoO2反應。然而,LiCoO2的主峰在500 °C時突然消失,同時出現了雜質CoS2的峰。提高到800℃后,雜質峰的強度減弱,而Li2S峰加強,這可能是由于Li2S在此溫度下的再結晶造成的。
通過比較Li2S/S和LiCoO2之間反應產物的XRD圖譜,可以推斷出S與LiCoO2的反應比Li2S更嚴重。此外,這兩個反應過程產生不同的熱力學產物。S和LiCoO2的反應產物主要是Co9S8、CoO和CoS,而Li2S和LiCoO2的反應產物則主要是CoS2。
根據分解產物(S/Li2S)和LiCoO2的熱穩定性實驗結果,系統地研究了硫化物SE和LiCoO2之間的熱穩定性。文獻中報道的硫化物SE主要是Li3PS4、Li6PS5Cl、Li7P3S11、Li4SnS4和LSPSCl,它們具有不同的晶體結構和離子傳導性。
例如,Li3PS4是γ-Li3PO4結構(空間群:Pmn21),Li6PS5Cl 是具有Ag8GeS6結構(空間群:F4?3m)的Argyrodite類型, Li7P3S11是高離子傳導性Ag7P3S11結構(空間群。P1?),Li4SnS4是一種高空氣穩定性的Ag8GeS6結構(空間群:Pnma),LSPSCl是一種超離子導電的LGPS結構(空間群:P42/nmc)。
將這些混合粉末加熱到指定溫度后,通過XRD對其反應產物的晶體結構演變進行了表征,從中推斷出化學反應過程。LiCoO的主要衍射[003]峰2,其強度最高,可作為化學反應的一個指標。Li6PS5Cl和LiCoO2的熱穩定性的實驗結果總結在圖2c。
結果顯示,Li6PS5Cl和LiCoO2在400℃以下沒有化學反應,除了少量的Li2S雜質峰。當溫度上升到500-600℃時,LiCoO2的主峰逐漸減弱,而反應產物(Co3S4,CoS2, Li2S)的衍射峰加強。因此,Li6PS5Cl和LiCoO2之間的化學反應也發生在大約500℃,并在600℃完成,這與Li3PS4和LiCoO2之間的現象相似。
實驗結果表明,不同的硫化物SE和LiCoO2之間的熱分解產物和反應溫度是不同的。例如,Li3PS4,Li6PS5Cl和Li4SnS4系統在500℃時開始反應,而Li7P3S11和LSPSCl系統則在400℃。這一現象似乎與硫化物SE的熱穩定性和分解產物密切相關。
通過分析硫化物SE和LiCoO2的熱穩定性,Li3PS4、Li6PS5Cl和Li4SnS4的反應起始溫度非常接近,而Li7P3S11和LSPSCl的反應起始溫度則相對較低。大多數硫化物SE與LiCoO2在400-500℃時發生反應,這與Li2S/S和LiCoO2的熱穩定性相似。
例如,這些硫化物SE在500℃時的主要Co-S分解產物是Co9S8,這與S和LiCoO2的情況相同。因此,推測分解產物在這些典型的硫化物SE和LiCoO的反應中起著重要作用2。根據以前的實驗,可以推斷出S與氧化物陰極的反應性要高于Li2S。
因此,推測Li7P3S11和LiCoO2在400℃下的反應是由Li7P3S11本身及其分解產物S的熱穩定性差引起的。此外,由于Li6PS5Cl具有良好的熱穩定性,其分解產物主要是Li2S,Li6PS5Cl和LiCoO2的初始反應溫度更高(約500℃)。此外,反應產物主要是Co3S4、CoS2、Li2S,這與Li2S和LiCoO2的反應產物類似。
圖2c實驗結果(黑色實心三角)和硫化物SEs的初始分解溫度(藍色實心球)被系統地總結在圖2d。發現硫化物SEs和LiCoO2之間的熱穩定性與硫化物SEs有關。容易分解的硫化物SEs經常在低溫下與LiCoO2材料發生反應,而高穩定性的硫化物SEs則不會。
此外,值得注意的是,Li3PS4/Li7P3S11的分解溫度低于它們與LiCoO2的初始反應溫度,而Li6PS5Cl/Li4SnS4/LSPSCl 則相反。這一現象表明,硫化物SE的分解產物將影響它們與LiCoO2的熱反應,這與它們固有的熱穩定性不同。此外,對于熱穩定性差的Li3PS4和Li7P3S11,它們的分解產物主導了它們與LiCoO2的熱化學反應,使得與它們直接接觸的化學反應變得次要。
對于Li6PS5Cl, Li4SnS4, 和具有良好熱穩定性的LSPSCl,其反應順序正好相反。 根據上述實驗,發現硫化物SE和LiCoO2之間的化學反應過程分為兩個過程。一個是兩個反應物之間的直接接觸,而另一個是涉及硫化物SEs的熱分解產物的化學反應,沒有直接接觸。
為了分離這兩個反應過程,設計并實施了它們沒有直接接觸的熱穩定性實驗(圖3)。為了實現兩種反應物的完全分離,硫化物SE被壓成緊湊的顆粒,并卡在石英管的中間,以避免與底部的LiCoO2的直接接觸。然后將特別設計的石英管加熱到500℃,根據以前的實驗,這相當于啟動反應的溫度。
在實驗操作過程中,石英管被燒毀,在LiCoO2和硫化物SE之間形成一個物理間隔(約3-8cm)。密封的石英管可以提供一個無干擾的純凈實驗環境(H2O≤0.1ppm,O2≤0.1ppm),盡可能減少意外污染對實驗結果的干擾。通過表征Li6PS5Cl和Li(更敏感)在密封前后的結構變化,也驗證了密封操作過程的可靠性。
此外,通過EDX檢測Li6PS5Cl粒子表面的組成。結果發現,Li6PS5Cl的形態和成分在密封前后沒有明顯變化,這進一步證實了密封操作過程的可靠性。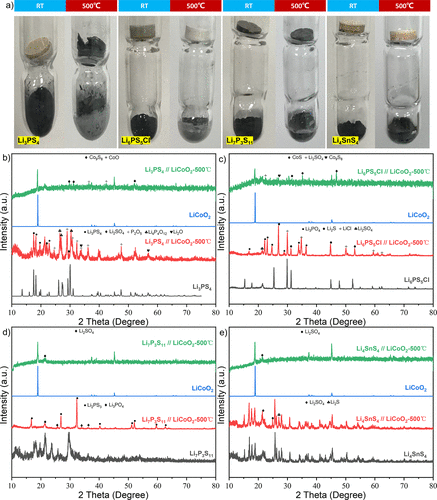
圖3.硫化物SE和LiCoO2間接接觸的熱穩定性實驗。(a) 典型的硫化物SE顆粒和LiCoO2粉末在加熱前和加熱后的照片(硫化物SE在上面,LiCoO2在下面)。(b-e) 這些SEs顆粒和LiCoO2在間接接觸熱處理之前和之后的XRD圖譜。 圖3a顯示了在這個特殊裝置中加熱前和加熱后的照片對比。
盡管硫化物SEs顆粒沒有與LiCoO2接觸,但在加熱過程中,它們的顏色在反應后仍然發生了很大變化。在加熱前后對硫化物SEs和LiCoO2進行了XRD測試,以研究其結構和相變。圖3b顯示了Li3PS4和LiCoO2的結果。加熱后LiCoO2的主要衍射峰沒有大的變化,但出現了雜質Co9S8峰,根據上述實驗結果,這可能是LiCoO2和S的反應產物。
同時,Li3PS4峰消失了,而Li2SO4,P2O5,Li4P4O12,Li2O 峰出現了(圖3b)。這證明了Li3PS4和LiCoO2之間的熱反應不需要直接接觸。
由Li3PS4產生的分解產物S將優先揮發,然后擴散到陰極材料,誘發與LiCoO2的氧化還原反應。更有趣的是,LiCoO2本身在500℃下不會分解或釋放氧氣,但分解產物(汽化的S)會與LiCoO2反應,釋放出結構受損的O2氣體。然后這種O2氣體會再次與Li3PS4反應,以促進其分解。
在研究NMC和Li3PS4的熱穩定性時,Tsukasaki等人發現NMC分解成過渡金屬硫化物并釋放出O2,然后Li3PS4被氧化成Li3PO4。這個過程與這里觀察到的實驗證據非常相似。圖3c總結了熱處理前后Li6PS5Cl和LiCoO2(無直接接觸)的XRD圖譜。
加熱后,LiCoO2的[003]峰強度下降,出現了雜質Co9S8、CoS和Li2SO4的衍射峰。Li6PS5Cl峰幾乎消失,而Li3PO4、Li2S、LiCl和Li2SO4峰顯現出來。與Li3PS4和LiCoO2之間的反應類似,即使Li6PS5Cl和LiCoO2沒有直接接觸,少量的揮發性分解產物也會通過擴散過程引起嚴重的化學反應。
Li7P3S11和LiCoO2的實驗結果在圖3d中展示。LiCoO2的[003]峰強度明顯下降,同時出現了一個雜質峰(Li2SO4)。Li7P3S11也轉變為Li3PO4和Li2PS3。對于Li4SnS4+ LiCoO2的混合物,LiCoO2的演變行為與Li7P3S11+ LiCoO2的演變行為一致(圖3e)。
不同的是,Li4SnS4的主要衍射峰在反應后沒有明顯變化,但Li2S和Li2SO4的少量雜質峰出現了。Tsukasaki等人認為,根據 "軟硬酸堿理論"(HSAB),Sn是一種比P更軟的酸,導致Li4SnS4對O2的穩定性高于其他硫化物SE。為了進一步分析硫化物SE和LiCoO2的兩種反應機制,對直接/間接接觸化學反應的實驗結果進行了比較和分析。
當Li4SnS4+ LiCoO2的混合粉末被加熱到500℃時,LiCoO2的峰值會明顯消失,表明Li4SnS4和LiCoO2的直接接觸會引起化學反應。然而,在間接接觸實驗中,Li4SnS4可以在相同的溫度下保持其結構。
因此,對于Li4SnS4和LiCoO2之間的熱化學反應,直接接觸的化學反應可能優先于涉及分解產物的化學反應。另一方面,硫化物SE的空氣穩定性在與氧化物陰極材料的熱化學反應中也起到了不可忽視的作用。 結論是,即使硫化物SE和氧化物陰極材料(Li1–xCoO2)沒有直接接觸,也會通過揮發性的分解產物發生嚴重的化學反應,這些分解產物主要是由硫化物SE/陰極材料分解產生的S/O化合物。
本節的實驗結果表明,硫化物SE和Li1–xCoO2之間存在兩類反應過程(即直接接觸反應和間接接觸反應)。其中,硫化物SEs及其分解產物的熱穩定性在間接接觸反應中起著重要作用。
熱穩定性差的SE,如Li3PS4和Li7P3S11,在間接接觸化學反應中優先與LiCoO2,而不是直接接觸過程。對于具有良好熱穩定性的SE,如Li6PS5Cl和Li4SnS4,直接接觸的化學反應將優先于間接接觸過程。此外,硫化物SE的空氣穩定性在涉及分解產物的化學反應中也起著不可忽視的作用,這與HSAB理論一致。
典型硫化物SE和脫鋰陰極Li1–xCoO2之間的熱穩定性 氧化物陰極材料的熱穩定性將隨著其脫鋰程度的加深而惡化。在對液體LIB的熱穩定性研究中,熱失控時釋放的主要熱源是脫鋰電極和LE的燃燒熱。因此,對脫鋰電極材料和電解質之間的熱穩定性的研究也很有意義。
為了探索典型的硫化物SE(Li3PS4, Li6PS5Cl, Li7P3S11, Li4SnS4, LSPSCl)和Li1–xCoO2之間的熱穩定性關系,在相同的條件下,采用上述的實驗方法分析其晶體結構隨直接/間接接觸的演變(圖4和5)。在研究材料的熱穩定性時,化學脫鋰是獲得脫鋰電極材料的一種非常普遍的方法。選擇這種方法制備Li1–xCoO2樣品的原因是為了避免電化學過程中粘合劑、導電添加劑和電解質的影響,并滿足本實驗的用量。
通過化學脫鋰法制備了不同脫鋰狀態的Li1–xCoO2(x= 0.3, 0.5),如圖4a所示。通過電感耦合等離子體光譜(ICP)測試了脫鋰的Li1–xCoO2的Li和Co元素,以評估脫鋰材料的制備情況。結果發現,通過化學脫鋰方法制備的不同脫鋰Li1–xCoO2(x= 0, 0.3, 0.5)粉末符合設計要求,沒有其他雜質。通過SEM-EDX對化學脫鋰的Li0.7CoO2粉末的形態和表面組成進行了分析,如圖4b所示。
發現LiCoO2的顆粒結構有少量的層狀裂紋,這與脫鋰后的層狀氧化物陰極的結構變化相似。顆粒表面沒有明顯的異常雜質元素,這表明通過化學脫鋰法制備的脫鋰陰極Li1–xCoO2具有較高的純度。圖4c中比較了不同脫鋰狀態的Li1–xCoO2(x= 0, 0.3, 0.5)的XRD圖。
發現當x= 0.5時,雖然LiCoO2的主要結構仍然存在,但主峰的強度減弱,并轉移到一個較低的角度。從不同脫鋰狀態的Li1–xCoO2的TG圖譜可以發現,隨著脫鋰程度的加深(x= 0.5),Li1–xCoO2的失重現象更加嚴重。這是因為Li1–xCoO2中的O的穩定性隨著鋰離子的缺乏而越來越差,隨著溫度的升高,氧氣逐漸釋放出來。
比較Li6PS5Cl和Li1–xCoO2(x= 0, 0.3, 0.5)在不同溫度下的反應產物的XRD圖譜(圖2c,圖4d),可以發現Li6PS5Cl和LiCoO2在400℃時沒有發生化學反應,甚至在500℃時LiCoO2的主峰依然保持。當溫度達到300℃時,混合粉末(Li0.7CoO2+ Li6PS5Cl)的衍射圖譜沒有明顯變化,而Li0.5CoO2混合粉末則出現了明顯的雜質峰(26.9°, 36.1°)。將溫度提高到400℃,LiCoO2的主峰完全消失,取而代之的是脫鋰狀態研究體系中的雜質(Co3S4,Li2S,CoS2,P2O5)。
雜質類型與LiCoO2和Li2S的反應產物一致(圖2b)。隨著溫度的升高,Li6PS5Cl和Li1–xCoO2(x= 0, 0.3, 0.5)混合粉末的演化行為最終趨于一致。脫鋰的Li1–xCoO2會比LiCoO2更容易與硫化物SE反應,這與它們不穩定的晶體結構和可氧化性密切相關。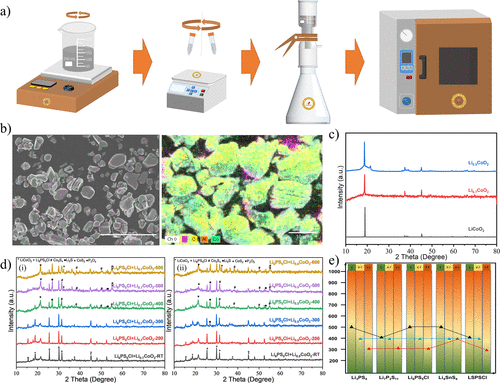
圖4.不同脫鋰狀態的Li1–xCoO2和典型的硫化物SE(Li3PS4, Li6PS5Cl, Li7P3S11, Li4SnS4, LSPSCl)之間的熱穩定性。(a)用化學方法制備不同脫鋰狀態的Li1–xCoO2的原理圖。(b) 通過SEM-EDX分析化學脫鋰的Li0.7CoO2粉末的形態和表面組成。(c) 具有不同脫鋰狀態的Li1–xCoO2的XRD圖譜。(d) 熱處理后的Li6PS5Cl和Li1–xCoO2的XRD圖譜:(i) Li0.7CoO2和(ii) Li0.5CoO2。(e) 混合粉末(硫化物SE和Li1–xCoO2)的穩定性趨勢。黑色、藍色和紅色的三角形分別指LiCoO2、Li0.7CoO2和Li0.5CoO2。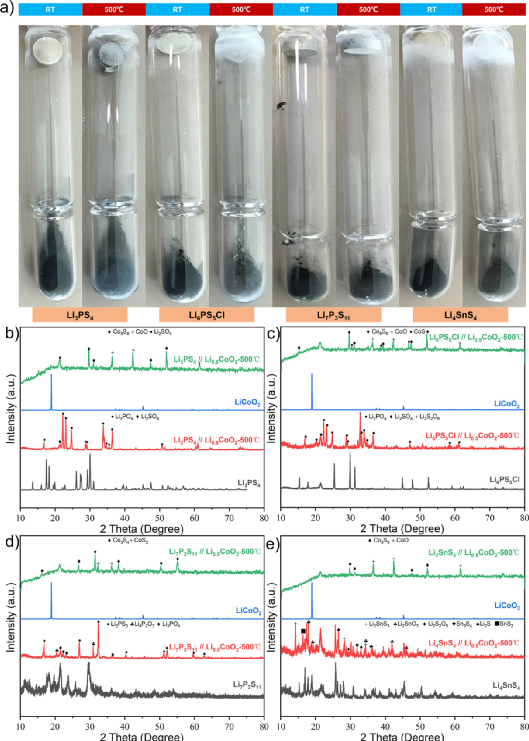
圖5.脫鋰的Li0.5CoO2的熱穩定性,不與硫化物SE直接接觸。(a) 典型的硫化物SE顆粒(Li3PS4, Li6PS5Cl, Li7P3S11, Li4SnS4)和Li0.5CoO2熱處理前后的照片。(b-e) 硫化物SE和Li0.5CoO2在熱處理之前和之后不直接接觸的反應產物的XRD圖譜。 圖4e總結了不同脫鋰狀態(x= 0, 0.3, 0.5)的Li1–xCoO2和硫化物SE之間的熱穩定性結果。隨著x的增加,Li1–xCoO2和硫化物SEs之間的初始反應溫度被降低了。原因是Li1–xCoO2的氧化性提高,O在晶體結構中的穩定性降低,更容易釋放。
Yamaki等人發現,隨著脫鋰程度的加深,氧化物陰極材料的熱穩定性逐漸退化,脫鋰的氧化物陰極在加熱過程中會逐漸釋放氧氣。MacNei等人認為,Li0.5CoO2的熱分解過程如下。Li0.5CoO2→ 1/2 LiCoO2+ 1/6Co3O4+ 1/6O2。由于Li4SnS4對H2O和O2有很高的耐受性,Li4SnS4與Li0.5CoO2/Li0.7CoO2的初始反應溫度接近(約400℃)。
同樣,Li7P3S11與LiCoO2/Li0.7CoO2之間的反應起始溫度也是一樣的,但主要是由于Li7P3S11產生S的穩定性差。總之,Li1–xCoO2和硫化物SE之間的熱穩定性受到硫化物SE本身的熱穩定性、Li1–xCoO2的氧化作用、揮發性分解產物和硫化物SE的空氣穩定性(由HSAB理論決定)的影響。
根據上述實驗結果(圖3),LiCoO2在低溫下會釋放氧氣,并在硫化物SE的分解產物的影響下氧化硫化物SE。由于Li0.5CoO2比Li0.7CoO2更容易釋放O2,它與硫化物SEs的熱反應可能更劇烈。
因此,用上述類似的方法對LiCoO2(具有不同的脫鋰狀態)和硫化物SE之間的熱穩定性進行了描述。圖5a中的結果顯示了硫化物SE顆粒的明顯反應。有趣的是,與圖3中的不同,Li0.5CoO2粉末的顏色變淺,粉末表面出現白色顆粒,這在與Li6PS5Cl的反應中尤為明顯。
為了獲得熱處理后無直接接觸的結構變化,對反應前后的粉末進行了XRD測試。圖5b顯示了Li3PS4和Li0.5CoO2熱處理前后反應產物的XRD圖。
Li0.5CoO2主要轉化為Co9S8、CoO、Li2SO4等,Li3PS4轉化為Li3PO4和少量的Li2SO4。對于Li6PS5Cl + Li0.5CoO2混合物(圖5c),Li0.5CoO2主要轉化為Co9S8、CoO、CoS等,而Li6PS5Cl在加熱到500℃時,變為Li3PO4、Li2S2O6和Li2SO4。對于Li7P3S11+ Li0.5CoO2(圖5d),Li0.5CoO2完全變為Co3S4和CoS2,,而Li7P3S11轉化為Li2PS3, Li4P2O7, 和Li3PO4。對于Li4SnS4+ Li0.5CoO2(圖5e),Li0.5CoO2全部轉化為Co9S8和CoO,Li2S2O5, Li2SnS3, Li2SnO3,Sn3S4, Li2S,SnS2,等,是Li4SnS4的主要產物。
與Li3PS4+ LiCoO2的熱化學反應相比,Li3PS4和Li0.5CoO2的反應更加激烈和完整。圖3b顯示,LiCoO2+ Li3PS4的主要結構的衍射峰在500℃時保持不變,但在圖5b中Li0.5CoO2+ Li3PS4的衍射峰完全消失了。這表明Li0.5CoO2在較低的溫度下釋放出更多的氧氣,從而促進了反應的進行。
關于Li6PS5Cl和Li4SnS4,也觀察到同樣的實驗結果。然而,不同的是,Li7P3S11和LiCoO2/Li0.5CoO2之間的實驗結果相同,這是因為Li7P3S11的熱穩定性差。此外,盡管Li4SnS4對氧氣有很好的穩定性,但Li0.5CoO2的大量氧氣仍然可以破壞Sn-S鍵,形成Sn-O鍵(Li2SnO3)。
總之,Li1–xCoO2不僅與硫化物SEs直接反應,而且即使沒有直接接觸,也會釋放出大量的氧氣來進一步氧化硫化物SEs。Li1–xCoO2和硫化物SEs之間化學反應的強度與它們的脫鋰程度密切相關。因此,可以合理地認為,脫鋰的Li1–xCoO2分解釋放的氧氣即使沒有直接接觸也更容易擴散,并誘發更嚴重的熱穩定性問題或熱失控。
硫化物SE和Li1–xCoO2之間的反應動力學
到目前為止,關于硫化物SEs的熱穩定性的動力學機制很少被研究。為了補充這些數據,通過DSC技術研究了氧化物陰極材料和硫化物SEs混合粉末在不同狀態下的放熱過程。通過基辛格方法分析DSC結果,得到了化學反應的動力學參數(即頻率因子A和活化能Ea)。
活化能和頻率因子是描述化學動力學的關鍵參數,指的是熱化學反應中所需要的能量和有效分子間碰撞的頻率。對它們的準確估計對描述LIB成分在高溫下的熱不穩定性具有重要意義。基辛格方法是一種動力學分析工具,已被廣泛用于從不同掃描速率的DSC光譜中提取這兩個值。這兩個值與實驗數據之間的關系如下。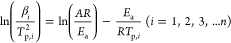
其中,βi代表溫度掃描率,Tp,i是反應峰值溫度,A是頻率因子,R是通用氣體常數,Ea代表活化能。i表示從1到n的試驗數。用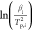 與
與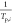 的線性擬合揭示了活化能和頻率因子的基本信息,通過計算直線的斜率和垂直截距可以分別確定其數值。 比較了不同脫鋰狀態的Li6PS5Cl + Li1–xCoO2?(x?= 0, 0.3, 0.5)混合粉末的DSC光譜(圖6a)。
的線性擬合揭示了活化能和頻率因子的基本信息,通過計算直線的斜率和垂直截距可以分別確定其數值。 比較了不同脫鋰狀態的Li6PS5Cl + Li1–xCoO2?(x?= 0, 0.3, 0.5)混合粉末的DSC光譜(圖6a)。
在LiCoO2+ Li6PS5Cl混合粉末中發現了兩個放熱峰。第一個峰值開始于大約375℃,最大熱通量信號在400℃,而第二個峰值開始于大約450℃,最大熱通量信號在大約475℃。然而,Li1–xCoO2(x= 0.3, 0.5)和Li6PS5Cl混合粉末有多個放熱峰。第一個放熱峰的起始溫度下降到200℃,峰值溫度約為225℃。
類似的現象也發生在其他硫化物SE(Li3PS4, Li7P3S11, Li4SnS4, LSPSCl),相應的放熱峰用紅色箭頭標識。圖6b總結了這些硫化物SE+Li1–xCoO2(x= 0, 0.3, 0.5)的混合物的第一個放熱峰的開始和峰值溫度。結果表明,隨著脫鋰程度的加深,它們的放熱反應將在較低的溫度(150-200℃)下得到促進。
這充分證明了可燃物(硫化物SE)和氧化劑(氧化物陰極材料)在不同的脫鋰狀態下可以在適當的溫度范圍內誘發放熱反應。有趣的是,這些溫度明顯低于圖4e中的溫度。這是因為DSC的精度/靈敏度比馬弗爐和XRD測試的溫度控制要高得多。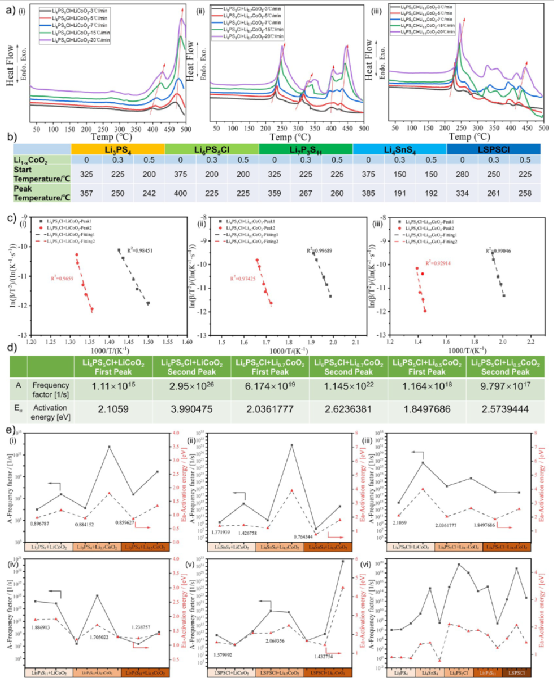
圖6.Li1–xCoO2(x= 0, 0.3, 0.5)和典型的硫化物SE之間化學反應的動力學特征測試。(a) Li1–xCoO2+ Li6PS5Cl混合粉末在不同加熱速率(3, 5, 7, 15, 20 °C/min)下的DSC曲線。(b) 不同硫化物SEs + Li1–xCoO2混合粉末的DSC曲線中第一個放熱峰的對應溫度。(c, d) Li1–xCoO2+ Li6PS5Cl混合粉末的熱分析數據(基辛格法)。(e) 其化學反應的頻率因子A和活化能Ea。 采用基辛格法測定了Li1–xCoO2+ Li6PS5Cl混合粉末的活化能Ea和頻率因子A(圖6)。為了提高擬合精度,在混合粉體的多個峰中選擇峰形最好的放熱峰。
LiCoO2+ Li6PS5Cl混合粉末的第一和第二峰的頻率因子和活化能分別為A1= 1.11 × 1015S–1,Ea1= 2.1059 eV和A2= 2.95 × 1026S–1,Ea2= 3.990475 eV。這意味著第一個放熱過程更容易發生,但第二個放熱過程引起的碰撞頻率更高。或者說,第一個放熱過程常常作為鏈式反應的起點,而第二個放熱過程促進了反應過程,因為它的反應速率最高。Li0.7CoO2+ Li6PS5Cl混合物的第一個峰的頻率因子和活化能為A1= 6.174 × 1019S–1,Ea1= 2.0361777 eV,第二個峰的頻率因子和活化能為A2= 1.145 × 1022S–1,Ea2= 2.6236381 eV。
第一個放熱峰的活化能明顯低于LiCoO2+ Li6PS5Cl混合物的活化能,而頻率因子更高,這證實了上述實驗結果。對于Li0.5CoO2+ Li6PS5Cl混合物,動力學參數為A1= 1.164 × 1018S–1和Ea1= 1.8497686 eV(對于第一個峰值)和A2= 9.797 × 1017S–1和Ea2= 2.5739444 eV(對于第二個峰值)。較大的頻率因子和最小的活化能表明在三種脫鋰狀態中,Li0.5CoO2和Li6PS5Cl之間的反應最為劇烈,這與之前的現象一致。 圖6e中總結了典型的硫化物SEs和Li1–xCoO2(x= 0, 0.3, 0.5)的所有動力學參數。
總的來說,Li1–xCoO2和硫化物SE之間的熱反應可以分為兩個過程。第一個放熱過程顯示出較低的活化能Ea和較低的頻率因子A,表明這個過程是一個起始反應過程,很容易發生,但反應速率很低。相反,第二個放熱過程往往具有較高的活化能Ea和較高的頻率因子A,表明這個過程是一個劇烈的反應過程,不容易發生,但反應速率高。但也有例外,如Li7P3S11+ Li1–xCoO2(x= 0, 0.3)和LSPSCl + Li1–xCoO2(x= 0, 0.3)。
在LSPSCl + LiCoO2混合物的三個不同的放熱過程中,第二個放熱過程的活化能最低(Ea= 1.4546 eV),第一個放熱過程的頻率因子較高(A= 2.63 × 1012S–1),第三個放熱過程的頻率因子最高(A= 3.06 × 1013S–1)。同樣,在LSPSCl + Li0.7CoO2混合物的三個不同的放熱過程中,第三個放熱過程的活化能最低(Ea= 1.645073 eV),而第一個放熱過程的頻率因子最高(A= 9.05 × 1018S–1)。
這表明LSPSCl和Li1–xCoO2(x= 0, 0.3)的第一個過程促進了反應過程,釋放了熱量,并引發了后續的放熱反應。在Li7P3S11和Li1–xCoO2(x= 0, 0.3)混合物中,也是第一個放熱過程加速了后續反應。這些與圖4e中的結果一致,即Li7P3S11/LSPSCl + Li1–xCoO2(x= 0, 0.3)的熱穩定性差。從機理上看,硫化SE和Li1–xCoO2之間的熱穩定性是由反應熱力學和動力學共同決定的,其中Li7P3S11/LSPSCl和Li1–xCoO2之間的熱穩定性受反應動力學的影響很大。
阻斷硫化物SE和鈷酸鋰之間的熱化學反應
通過間接接觸實驗,發現硫化物SE通過揮發性分解產物與氧化物陰極材料相互作用。從脫鋰的Li1–xCoO2釋放的氧氣會加劇這一反應過程。為了進一步確認揮發性分解產物在這一過程中的作用,又進行了一個實驗,以驗證控制分解產物是否會減緩反應。在實時清除揮發性分解產物的前提下,設計了一個小型加熱裝置來處理硫化物SE和Li1–xCoO2,如圖7a所示。
利用真空泵和壓力控制閥使裝有樣品的石英管達到一定的真空度,并在整個反應過程中實時去除揮發性分解產物。為了避免真空系統對非揮發性分解產物的干擾,石英管被部分地冷卻了。這消除了硫化物SE和Li1–xCoO2加熱過程中揮發性分解產物的干擾。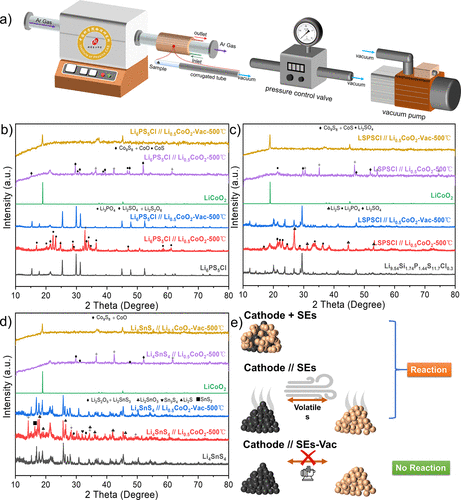
圖7.脫鋰的Li0.5CoO2和典型的硫化物SEs之間沒有直接接觸反應的真空實驗。(a) 脫鋰Li1–xCoO2和硫化物SEs之間無直接接觸的真空實驗示意圖,使用真空泵和壓力控制閥來實時保持石英管中的真空度。(b-d) Li0.5CoO2和硫化物SEs、Li6PS5Cl、LSPSCl和Li4SnS4之間間接接觸實驗的XRD衍射圖。(e) 通過去除揮發性分解產物抑制氧化還原反應進展的機制圖。 間接接觸實驗顯示,Li4SnS4+ LiCoO2和Li4SnS4+ Li0.5CoO2之間存在很大差異,這很可能是由Li1–xCoO2的氧氣釋放差異引起的。
為了進一步證實這一推論,我們選擇了在500℃下結構穩定的硫化物SE(Li4SnS4, Li6PS5Cl, LSPSCl)與Li0.5CoO2進行真空實驗,不直接接觸。更重要的是,根據上面的實驗結果,這些硫化物SE和Li1–xCoO2之間的熱化學反應主要是通過直接接觸進行的。
因此,可以確保本研究中的主要變量是Li1–xCoO2所釋放的氧氣。對這三種硫化物SE與Li1–xCoO2(x=0,0.5)進行XRD測試,研究結構變化(圖7b-d)。在間接接觸的條件下,Li6PS5Cl(圖7b)被完全氧化為Li3PO4,Li2SO4,Li2S2O6等,Li0.5CoO2被完全還原為Co9S8,CoO,CoS等。
然而,在真空系統中,Li6PS5Cl和Li0.5CoO2保持了它們的原始結構。這表明,當揮發性分解產物的運輸被切斷時,Li6PS5Cl和Li0.5CoO2的分解會被抑制,它們之間的反應也會被抑制。
在圖7c中,在間接接觸條件下,LSPSCl仍然被氧化成Li2S, Li3PO4, Li2SO4等,其衍射峰完全消失,而Li0.5CoO2被分解成Co9S8,CoS和Li2SO4,沒有任何原始衍射峰。然而,LSPSCl-Li0.5CoO2的分解被真空系統明顯抑制。在圖7d中,具有較好空氣穩定性的Li4SnS4在間接接觸條件下與Li0.5CoO2共聚時,分解為Li2SnS3,Li2SnO3,Sn3S4,Li2S和SnS2,而Li4SnS4+ Li0.5CoO2的衍射峰在真空體系中保持不變。
圖7e是硫化物SEs和Li1–xCoO2在高溫下的反應過程示意圖。根據以前的實驗結果,典型的硫化物SE和Li1–xCoO2之間會發生嚴重的放熱化學反應。即使它們沒有直接接觸,也會通過揮發性的分解產物發生化學反應。這個過程與陰極的脫鋰狀態和硫化物SE本身的熱穩定性密切相關。
這與上面的實驗結論是一致的。在圖3c和e中,Li6PS5Cl/Li4SnS4和LiCoO2間接接觸的熱穩定性結果表明,即使溫度遠低于Li6PS5Cl和Li4SnS4的分解溫度,其極少量的自我分解產物也會促進其反應。通過真空系統去除硫化物SE的揮發性分解產物,硫化物SE/Li1–xCoO2的熱分解和兩種成分之間的化學反應都將受到抑制。
因此,可以通過真空系統或使用吸附劑去除分解反應釋放的氧氣和硫磺,以防止發生更嚴重的放熱反應(熱失控行為)。換句話說,硫化物SE基ASSB的熱安全性可以得到有效改善。 在LiCoO2和Li4SnS4的間接接觸實驗中,發現Li4SnS4的主要衍射峰在反應前后沒有變化,只有Li2S 和Li2SO4的極少量的雜質峰出現。
因此,這里進一步采用了陰極涂層的方法來防止LiCoO2和Li4SnS4之間的直接接觸,這樣可以有效地抑制熱反應。
具體來說,Li2O-ZrO2-涂層的LiCoO2@LZO(LZO═Li2O-ZrO2)是通過溶膠-凝膠法制備的,然后與Li4SnS4混合并進行熱處理。圖8b顯示了LiCoO2+ Li4SnS4混合粉末在不同溫度下的XRD圖譜,從中可以看出它們的熱化學反應發生在500℃。
然而,在圖8c中,Li4SnS4和LiCoO2@LZO的主要峰在500℃時仍然存在,這樣它們之間沒有發生劇烈的熱化學反應。結論是,表面涂層可以在一定程度上有效改善硫化物ASSB的界面熱穩定性。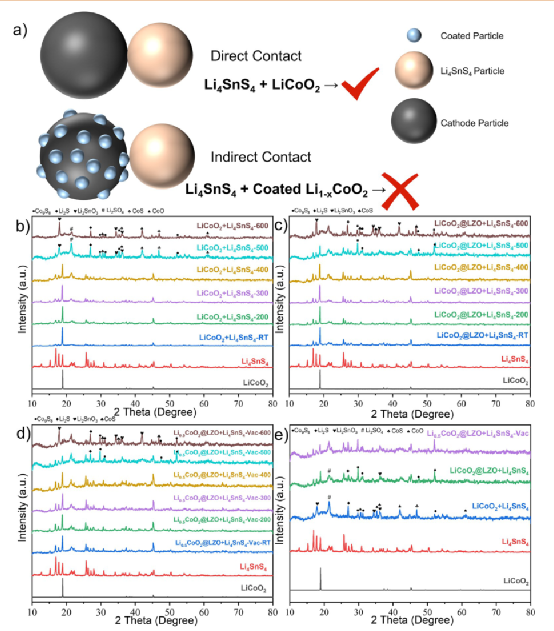
圖8.表面涂層的LiCoO2和Li4SnS4的熱穩定性實驗。(a) 未涂層/涂層的LiCoO2和Li4SnS4的反應示
意圖。(b) LiCoO2和 Li4SnS4混合粉末的XRD圖譜。(c) LiCoO2@LZO和Li4SnS4混合粉末的XRD圖譜。(d) LiCoO2@LZO和Li4SnS4混合粉末在真空中熱處理后的XRD圖譜。(e) 未涂層/涂層的LiCoO2和Li4SnS4混合粉末在500℃下的XRD結果比較。
此外,結合真空系統,涂層也適用于脫鋰的LiCoO2。Li0.5CoO2可以在500℃下與Li4SnS4發生反應,而不需要直接接觸,因為它的可氧化性增加了,不管兩個成分之間的距離如何。然而,在沒有直接接觸的真空實驗中,Li4SnS4和Li0.5CoO2可以在500 °C下保持其原始結構。對于Li0.5CoO2@LZO + Li4SnS4混合物,當溫度低于400℃時,在真空系統中它們之間沒有發生明顯的化學反應(圖8d)。當溫度達到500℃時,只有少量的雜質出現,Li0.5CoO2和Li4SnS4的主要衍射峰仍然存在。
直到溫度達到600℃,大量的雜質峰出現,Li0.5CoO2和Li4SnS4的主要衍射峰相對較弱。因此,Li0.5CoO2@LZO +Li4SnS4混合粉末之間的化學反應將在真空系統中被抑制。 圖8e總結了上述不同實驗條件下混合粉體在500℃下的XRD圖譜。該涂層技術可以實現對硫化物SE和LiCoO2,有效隔離揮發性分解產物,從而抑制其熱化學反應。
這種涂層技術并不限制涂層材料的種類和制備方法。本工作中應用的LZO主要是因為其適當的離子傳導性、方便和低成本。此外,一些有效的涂層也值得考慮,如LiNbO3,TaO3,Al2O3,TiO2,Li2SiO3,Li4Ti5O12,LiTaO3,LiAlO2,Li3AlF6,LiAl5O8,以及MgSiO2。圖8d顯示了無涂層/有涂層的LiCoO2和Li4SnS4之間的反應過程。隨著脫鋰程度的加深,涂層技術本身不能有效抑制熱化學反應。然而,如果結合額外的真空系統,硫化物SE和脫鋰的Li1–xCoO2之間的熱化學反應可以有效減少。
盡管真空系統對于小規模的電池系統來說很難實現,但在電池組或電池模塊的規模上,它并不特別難實現。此外,能夠去除揮發性分解產物的吸附劑也可以發揮真空系統的作用,在電池層面改善硫化物SE和電極材料的熱穩定性。 涂層方法可以有效地改善硫化物SE和氧化物陰極材料之間的熱穩定性,抑制它們的熱化學反應。
然而,涂層是否會影響電池的電化學性能也值得研究。特別的有報道說,LZO可以大大改善硫化物ASSBs中LiNi1/3Mn1/3Co1/3O2的性能。因此,LIBs(LE:1 M LiPF6-EC/EMC)和ASSBs(SE:Li6PS5Cl)以金屬鋰為陽極,LiCoO2/LiCoO2@LZO為陰極組裝起來進行電化學性能測試(圖9)。
令人驚訝的是,LiCoO2@LZO在LIBs中的性能不如LiCoO2(圖9a)。LiCoO2/LiCoO2@LZO LIBs的第一、第五和第八周期的放電容量分別為183.4/171.7 mAh g–1,183.1/170.5 mAh g–1,和176.8/139.2 mAh g–1。同時,它們的初始庫侖效率分別為94.9%和93.7%,在第80個周期的容量保持率分別為96.4%和81.1%。
只有當充電的截止電壓降低到4.2V時,放電容量保持率才能得到適當的改善。這可能是由于在溶膠-凝膠制備過程中,LiCoO2的輕微腐蝕和LZO涂層的電子傳導性差。然而,LiCoO2@LZO在ASSB中的性能是相當可觀的(圖9b)。LiCoO2/LiCoO2@LZO ASSBs的第一和第五周期的放電容量分別為118.9/121.9 mAh g–1和 115.8/120.8 mAh g–1。
最初的庫侖效率分別為93.8%和91.8%,這與LIB的性能接近。LiCoO2@LZO ASSB即使在高的充電截止電壓(4.5V)下,仍然有85.9%的初始庫侖效率和167.6 mAh g–1的放電容量。在速率性能測試中,即使在4C的速率下,LiCoO2@LZO ASSB仍然保持110.1 mAh g–1的放電容量,容量保持率為90.1%(與0.5C相比)。
經過250次循環,它仍然保持107.3 mAh g–1,而LiCoO2ASSB的放電容量只有91.3 mAh g–1,容量保持率為76.3%(與0.5C相比,圖9c,d)。總之,雖然通過溶膠-凝膠法得到的LiCoO2@LZO有一定程度的容量衰減,但仍能有效防止與硫化物SE的界面反應,在ASSB中具有優良的電化學性能。
在保證原有氧化物陰極材料電化學性能的前提下,通過優化涂層制備方法,在表面形成有效的隔離層,硫化物ASSB的熱穩定性和電化學性能將得到極大改善。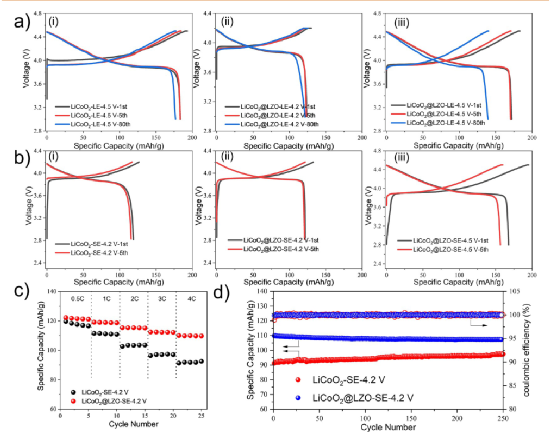
圖9.LiCoO2/LiCoO2@LZO 的電化學性能,包括循環和速率性能。(a) LIBs中的電化學性能(LE:1 M LiPF6-EC/EMC),(i) LiCoO24.5V,(ii) LiCoO2@LZO 4.2V,(iii) LiCoO2@LZO 4.5V。(b) ASSBs(SE:Li6PS5Cl)的電化學性能,(i)LiCoO24.2V,(ii)LiCoO2@LZO 4.2V,(iii)LiCoO2@LZO 4.5V。(c)這些ASSBs的速率性能比較。所有的ASSB都在55±3°C的2.5-4.2V的電壓范圍內進行測試。(d) 這些ASSB的長期循環性能的比較(4C,1C=135 mA g–1)。
【結論】
電化學儲能技術的快速發展和電動汽車的快速推廣,對儲能裝置提出了更高的安全要求。與傳統的揮發性/易燃性LEs相比,SEs和ASSBs被認為是相對安全的。在發現LAGP和金屬鋰之間的劇烈燃燒反應后,SEs和ASSBs的熱穩定性已成為該領域的主要關注點和熱門研究課題。
然而,由于硫化物SEs的穩定性差、腐蝕性強、對測試環境/儀器的要求苛刻,對其進行熱研究的報道很少。本文專門設計了兩種熱處理方法(即直接接觸和間接接觸),系統地研究了典型硫化物SEs(Li3PS4, Li7P3S11, Li6PS5Cl, LSPSCl, Li4SnS4)和Li1–xCoO2不同脫鋰狀態的熱力學和動力學特征。
主要結論如下:
(1)發現硫化物SE具有一定的還原性/可燃性,在電池的熱失控過程中可以作為可燃物使用。當它們與電極材料混合時,將發生明顯的劇烈燃燒。
(2)展示了典型的硫化物SE和LiCoO2之間的熱穩定性規律。結果表明,它們熱反應的初始溫度范圍為400-500℃,分解產物在這個熱化學反應過程中起著重要作用。即使沒有直接接觸,硫化物SEs和Li1–xCoO2之間也會通過揮發性分解產物發生熱化學反應。此外,熱穩定性差的硫化物SE更傾向于涉及分解產物的熱化學反應,而熱穩定性好的硫化物SE則更喜歡直接接觸的熱化學反應。
(3)驗證了典型的硫化物SE和不同脫鋰狀態的Li1–xCoO2之間的熱穩定性規律。結果表明,它們的熱穩定性受到硫化物SEs本身的熱穩定性、Li1–xCoO2的氧化特性、揮發性分解產物以及它們的空氣穩定性(由HSAB理論決定)的影響。與原始的LiCoO2相比,脫鋰的Li1–xCoO2具有更高的氧化性能,而且與硫化物SE的熱穩定性更差。此外,由于深度脫鋰的Li1–xCoO2釋放出大量的氧氣,即使沒有直接接觸,也能氧化高度空氣穩定的Li4SnS4。
(4)通過基辛格方法得到了其熱化學反應的兩個關鍵動力學參數(活化能和頻率因子)。發現化學反應主要分為兩個階段,即起始反應過程和劇烈反應過程。起始反應過程容易發生,但反應速率低,而劇烈反應過程不容易發生,但反應速率高。因此,硫化SE和Li1–xCoO2之間的熱穩定性由反應熱力學和反應動力學共同決定,其中Li7P3S11/LSPSCl和Li1–xCoO2之間的熱穩定性受反應動力學影響很大。
(5)應用真空系統成功地消除了揮發性分解產物對硫化物SE和Li1–xCoO2的影響,抑制了單一成分的熱分解。從實際應用的角度來看,硫化物SE和Li1–xCoO2之間的熱化學反應可以通過陰極涂層技術、反應產物吸收劑或真空系統的應用得到有效抑制。更重要的是,通過優化涂層材料和制備技術,可以提高ASSB的電化學性能和熱穩定性。
雖然上述研究成果從反應熱力學和動力學方面證明了硫化物SEs與氧化層陰極之間的熱穩定性特征,但仍有豐富的反應機理和反應驅動力需要從不同角度進一步探索。硫化物SEs和氧化物陰極之間的整體反應過程需要詳細地逐步解構,需要挖掘出決定性的反應步驟,這決定了提高它們之間熱穩定性的關鍵方向。
對于這些化學反應中的熱量、結構、成分、分解產物的有害性(毒性和可燃性)、驅動力等因素,需要更加系統地進行探討和總結。值得注意的是,本研究中使用的表征方法非常普遍,提供的信息往往不充分,這與硫化物的強揮發性和腐蝕性密切相關。因此,迫切需要開發適合硫化物SE和ASSB的熱表征技術,從不同的物理角度豐富信息。
此外,還有必要開發硫化物SEs的表面結構和非晶態成分的微觀分析技術。綜上所述,我們希望利用我們常用的表征方法,系統地研究典型的硫化物SE和氧化物陰極之間的一系列熱穩定性規律,提供一些有價值的參考,并作為該領域未來研究的指南。
審核編輯:劉清
-
電動汽車
+關注
關注
155文章
11942瀏覽量
230477 -
電解質
+關注
關注
6文章
805瀏覽量
20017 -
DMC
+關注
關注
0文章
19瀏覽量
19075 -
全固態電池
+關注
關注
0文章
57瀏覽量
4812
原文標題:中科院物理所吳凡ACS Nano:硫化物固態電解質與氧化物正極的熱穩定性
文章出處:【微信號:清新電源,微信公眾號:清新電源】歡迎添加關注!文章轉載請注明出處。
發布評論請先 登錄
相關推薦
華為公布硫化物固態電池新專利,固態電池技術加速發展
固態電池在儲能系統中的應用
如何選擇固態電池
無極電容器有電解質嗎,無極電容器電解質怎么測
不同類型的電池的電解質都是什么?
一種有機-無機非對稱固態電解質,實現長循環穩定的高壓鋰電池





 硫化物固態電解質與氧化物正極的熱穩定性
硫化物固態電解質與氧化物正極的熱穩定性











評論