01、導(dǎo)讀
鋰硫(Li-S)電池理論能量密度高、成本低,是最有前途的儲(chǔ)能系統(tǒng)之一。然而,放電期間從Li2S4到Li2S的緩慢還原動(dòng)力學(xué)阻礙了Li-S電池的實(shí)際應(yīng)用。盡管已經(jīng)提出了各種電催化劑來(lái)改善反應(yīng)動(dòng)力學(xué),但由于硫還原反應(yīng)(SRR)的復(fù)雜性,其電催化機(jī)理尚不清楚。因此,深入了解電催化機(jī)理對(duì)于設(shè)計(jì)先進(jìn)的電催化劑至關(guān)重要。
02、成果背景
近日,Angewandte Chemie International Edition上發(fā)表了一篇題為“An Electrocatalytic Model of the Sulfur Reduction Reaction in Lithium–Sulfur Batteries”的文章,該文章以雜原子摻雜碳材料為例,基于系統(tǒng)密度泛函理論計(jì)算,建立了鋰硫電池中SRR的電催化模型,揭示了SRR的化學(xué)機(jī)制。LiSy?(y=1,2或3)自由基的吸附能被用作預(yù)測(cè)反應(yīng)路徑、速率決定步驟和過(guò)電位的關(guān)鍵描述符。該研究為探索復(fù)雜的SRR機(jī)制和設(shè)計(jì)高性能鋰硫電池電催化劑提供了一個(gè)的理論模型。
03、關(guān)鍵創(chuàng)新
(1)本工作建立了一個(gè)電催化模型,用于探索SRR(Li2S4→ Li2S);
(2)通過(guò)LiSy?自由基(y=1、2或3)吸附過(guò)程中的吉布斯自由能變化(ΔGradical),可以確定SRR在工作電位下的速率決定步驟和能壘;
(3)最后,建立了η與ΔGradical值的關(guān)系圖,以指導(dǎo)先進(jìn)SRR電催化劑的設(shè)計(jì)。
04、核心內(nèi)容解讀
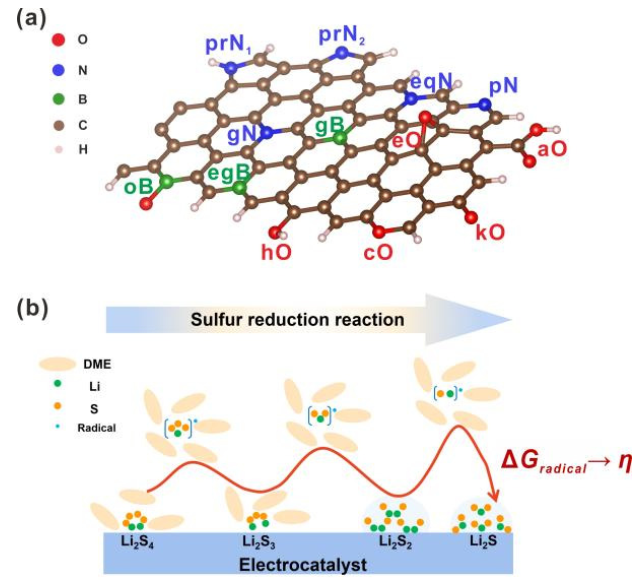
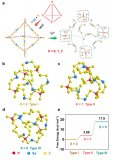
圖1.(a)雜原子摻雜石墨烯納米帶(X=O,N,B)和(B)鋰硫電池第二放電平臺(tái)的反應(yīng)機(jī)理示意圖。@Wiley
雜原子摻雜GNR(X摻雜GNR)因其優(yōu)異的導(dǎo)電性和在鋰硫電池中具有良好的電催化活性而被選為本工作中的電催化劑模型。通過(guò)將三種非金屬元素(X=N、O和B)取代邊緣或體相碳原子引入石墨烯基體,構(gòu)建了一系列周期性GNR模型。考慮了13種摻雜劑(圖1a),包括酮基(kO)、羧基(aO)、羥基(hO)、環(huán)氧基(eO)、環(huán)氧(cO)、石墨氮(gN)、吡啶氮(pN)、C–N–C型氮(eqN)、吡咯烷氮(prN1)、無(wú)氫吡咯烷(prN2)、石墨硼(gB)、B–2C–O型硼(oB)和C–B–C型硼(egB)。
由于SRR(圖1b)是六電子還原反應(yīng)(Li2S4+6Li++6e?→4Li2S),整個(gè)轉(zhuǎn)化過(guò)程分為六個(gè)基本步驟,生成一系列LiSy?自由基和Li2Sy分子。考慮到不同的溶解度,可溶性Li2S4、Li2S3和LiSy?自由基在DFT計(jì)算中被視為分子,而不溶性Li2S和Li2S2被視為晶體。
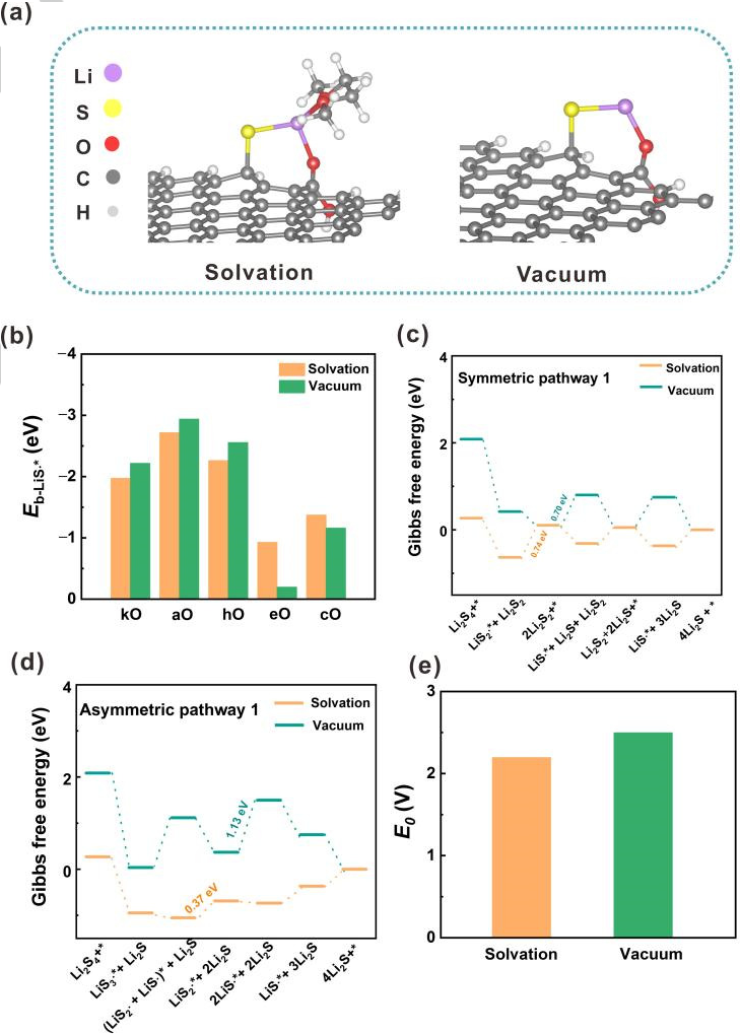
圖2.溶劑化和真空模型之間的比較。(a)LiS?自由基的吸附構(gòu)型,左:溶劑化模型;右:真空模型。(b)LiS?自由基在氧摻雜GNR上的吸附能(Eb)。在(c)對(duì)稱和(d)不對(duì)稱路徑中,U=2.15 V(vs.Li/Li+)時(shí)的自由能圖。(e)鋰硫電池第二平臺(tái)的計(jì)算平衡電位。@Wiley
由于溶劑化效應(yīng)在調(diào)節(jié)溶液中分子結(jié)構(gòu)和反應(yīng)行為中具有重要作用。因此,采用溶劑化模型與真空模型進(jìn)行比較(圖2a)。具體地,使一個(gè)或兩個(gè)1,2-二甲氧基乙烷(DME)分子分別與可溶性LixSy(x=1或2;y=1、2、3或4)自由基和分子相互作用。真空模型和溶劑化模型在含硫物質(zhì)的吸附能、SRR過(guò)程的速率決定步驟和鋰硫電池第二放電平臺(tái)的計(jì)算平衡電位(E0)方面表現(xiàn)出巨大差異。
首先,比較溶劑化和真空模型下的LiSy?自由基吸附能,以O(shè)摻雜GNR為例(圖2b)。盡管在兩種模型中,LiSy?自由基在O摻雜GNR上的吸附強(qiáng)度呈現(xiàn)出相同的趨勢(shì),但溶劑化效應(yīng)可以減弱或增強(qiáng)吸附。一般而言,在溶劑化模型中,摻雜kO、aO和hO的GNRs對(duì)LiS?自由基的吸附能比在真空模型中要小約0.25 eV,而eO摻雜的GNR的吸附能增加0.73eV。在摻雜O的GNRs上,LiS2?和LiS3?自由基也觀察到類似的現(xiàn)象。。
其次,溶劑化效應(yīng)可以調(diào)節(jié)SRR過(guò)程中的速率決定步驟。速率決定步驟被定義為在平衡電位下ΔG最大的步驟。以O(shè)摻雜GNR的SRR為例(圖2c、d),第二步是溶劑化模型中aO和hO摻雜GNRs的速率決定步驟。然而,在真空模型中第三步成為速率決定步驟。
第三,這兩個(gè)模型表現(xiàn)出非常不同的第二平臺(tái)E0。溶劑化模型的E0(2.19 V)與實(shí)驗(yàn)恒流間歇滴定技術(shù)的結(jié)果(2.10 V~2.20 V)極為相似。相反,真空模型的誤差為0.34 V(圖2e)。上述結(jié)果表明,溶劑化效應(yīng)在探究SRR機(jī)理中發(fā)揮了極其重要的作用,因此將溶劑化模型用于進(jìn)一步的計(jì)算。
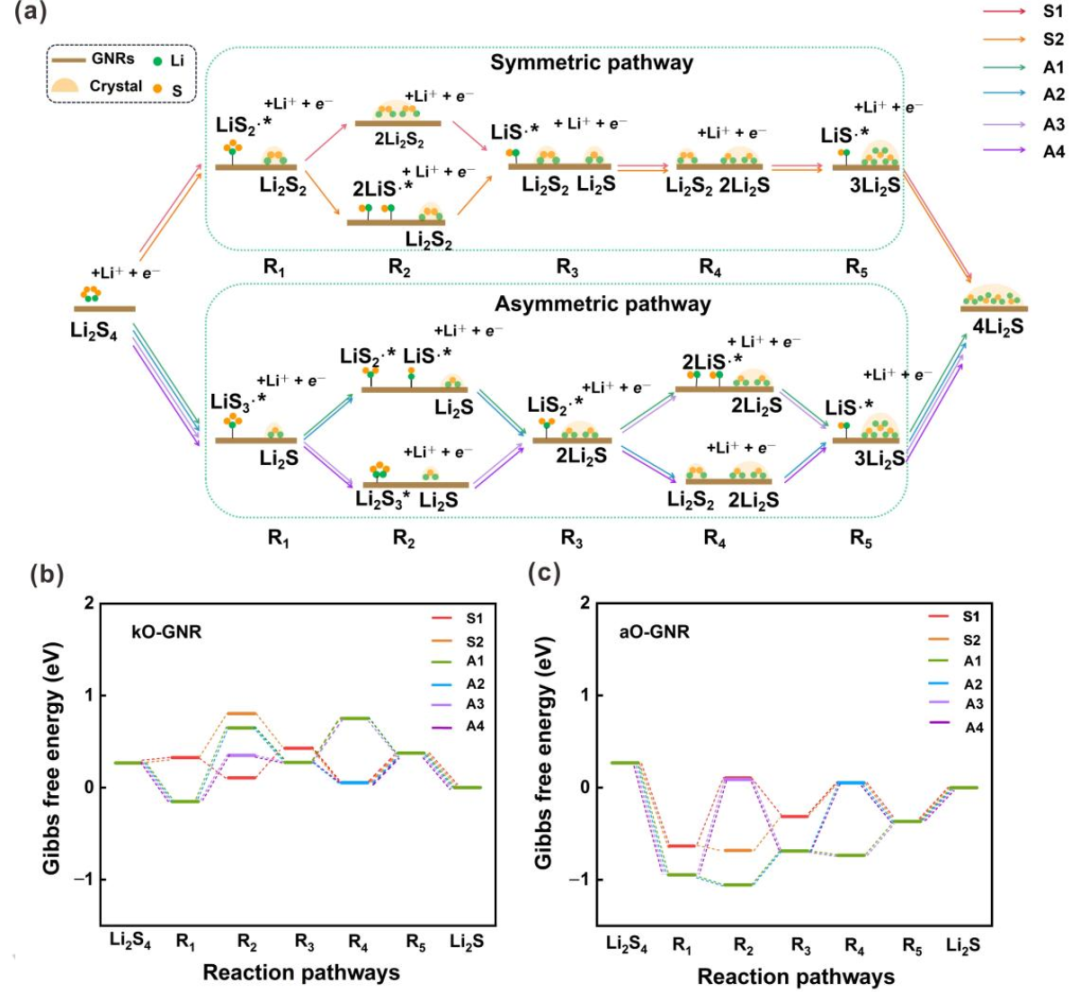
圖3.SRR過(guò)程反應(yīng)機(jī)理的探索。(a)所有可能反應(yīng)途徑的示意圖。(c)摻雜kO的GNR和(d)摻雜aO的GNG上六種可能路徑在U=2.15 V(vs.Li/Li+)下的自由能圖。S1–S2、A1–A4和R1–R5分別代表SRR過(guò)程中的對(duì)稱路徑、不對(duì)稱路徑和反應(yīng)中間體。@Wiley
通常,根據(jù)Li2S4分解機(jī)理,SRR反應(yīng)可主要分為兩類,即對(duì)稱路徑和不對(duì)稱路徑。然而,一些中間態(tài)總是比它們的最終產(chǎn)物具有更高的能量。例如,不對(duì)稱路徑中R1有兩種可能的狀態(tài),即LiS3?*+Li2S和LiS?*+Li2S3(*表示該物質(zhì)吸附在電催化劑上)。對(duì)于所有GNR,上一個(gè)總是比下一個(gè)更穩(wěn)定。因此,在排除不可能的路徑后,可以大大簡(jiǎn)化整個(gè)反應(yīng)路徑(圖3a)。在簡(jiǎn)化的機(jī)制中,Li2S4被還原為L(zhǎng)iS2?自由基和Li2S2,最后是對(duì)稱路徑中的Li2S。然而,Li2S4被還原為L(zhǎng)iS3?自由基和Li2S,最后是不對(duì)稱路徑中的Li2S。因此,SRR路徑可以進(jìn)一步細(xì)分為兩個(gè)對(duì)稱路徑(S1和S2)和四個(gè)不對(duì)稱路徑(A1–A4)。
在對(duì)稱路徑中,LiS2?*首先由吸附在表面上的Li2S4產(chǎn)生。然而,LiS2?*分別在對(duì)稱路徑S1和對(duì)稱路徑S2中的第二步轉(zhuǎn)化為L(zhǎng)i2S2固體或兩種LiS?*。在第三和第五步中,Li2S2固體可以進(jìn)一步還原并產(chǎn)生吸附自由基LiS?*和Li2S固體。LiS?*隨后在第四和第六步中轉(zhuǎn)化為L(zhǎng)i2S固體。隨后的四個(gè)步驟對(duì)于S1和S2路徑是相同的。因此,每一步的自由能變化(ΔGi)由等式(1)計(jì)算:
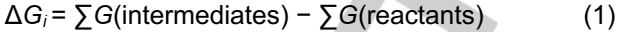
其中∑G(中間體)和∑G(反應(yīng)物)分別表示每個(gè)中間體和反應(yīng)物的吉布斯能之和。基于每個(gè)ΔGi的值,可以通過(guò)U=2.15 V(vs.Li/Li+)下的能量分布來(lái)探索SRR的反應(yīng)機(jī)理(圖3b、c)。對(duì)稱路徑S1在第二和第五步的能量變化比路徑S2低。因此,在對(duì)稱分解機(jī)制中,路徑S1是優(yōu)選的。
與對(duì)稱機(jī)制相比,包括四種不同分解路徑的不對(duì)稱機(jī)制要復(fù)雜得多,涉及更多中間體(圖3a)。吸附的LiS3?*自由基在所有四種路徑的第一步形成,但可以在以下步驟中進(jìn)一步轉(zhuǎn)化為不同的中間體。在不對(duì)稱路徑A1和A2中,LiS3?*在第二步分解成LiS2?*和LiS?*自由基,LiS?*自由基隨后轉(zhuǎn)化為L(zhǎng)i2S固體。而在不對(duì)稱路徑A3和A4中,第二步是形成Li2S3中間體,并進(jìn)一步產(chǎn)生吸附的LiS2?*自由基。在第四步時(shí),LiS2?*進(jìn)一步分裂為兩個(gè)LiS?*自由基,LiS?*自由基在不對(duì)稱路徑A1和A3中再次轉(zhuǎn)化為L(zhǎng)i2S固體。然而,在不對(duì)稱路徑A2和A4中,LiS2?*在第四步中進(jìn)一步還原為L(zhǎng)i2S2固體,并生成LiS?*。最后,LiS?*在第六步中轉(zhuǎn)化為L(zhǎng)i2S固體。根據(jù)能量分布(圖3b、c),不對(duì)稱路徑A1在第三、第四、第五和第六步的能量變化低于其他不對(duì)稱路徑A2–A4。因此,在不對(duì)稱分解機(jī)制中,途徑A1是優(yōu)選的。
根據(jù)U=2.15 V (vs. Li/Li+)時(shí)的能壘進(jìn)一步考慮對(duì)稱路徑S1和非對(duì)稱路徑A1之間的競(jìng)爭(zhēng)關(guān)系。aO、hO、pN、eqN、oB和egB摻雜的GNR更傾向于不對(duì)稱途徑A1,這表明在這六個(gè)X摻雜GNR上優(yōu)先產(chǎn)生LiS3?*。相反,其他7個(gè)摻雜X的GNRs產(chǎn)生固體Li2S2的主要路徑是對(duì)稱路徑。
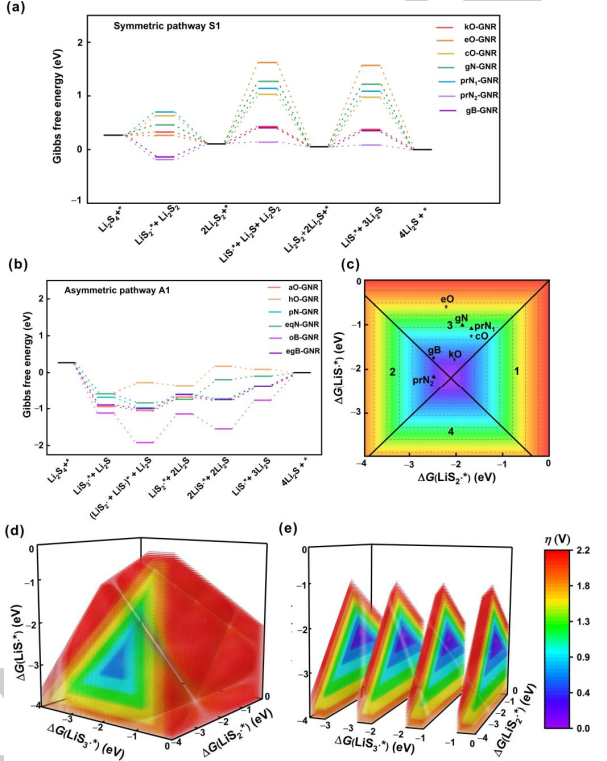
圖4.SRR的電催化模型。遵循(a)對(duì)稱路徑1和(b)不對(duì)稱路徑1的X摻雜GNR在U=2.15 V(vs.Li/Li+)下的自由能圖。將過(guò)電位與自由基在經(jīng)歷(c)對(duì)稱路徑和(d)不對(duì)稱路徑GNR上的吸附吉布斯自由能聯(lián)系起來(lái)的區(qū)域圖。(e)圖d的切片圖。@Wiley
圖4a、b給出了在2.15 V vs. Li/Li+條件下最有利反應(yīng)機(jī)理的自由能分布,用以比較不同雜原子摻雜的GNRs催化活性。第一步,吉布斯自由能隨著電勢(shì)的增加而上升,被視為SRR過(guò)程中的速率決定步驟。對(duì)稱路徑為不同電催化劑提供了不同的速率決定步驟(圖4a)。具體而言,Li2S2固體轉(zhuǎn)化為L(zhǎng)iS?*, 步驟3或步驟5是分別具有0.32、1.52、0.92、1.16、1.03和0.30 eV能壘的kO、eO、cO、gN、prN1和gB摻雜GNR的速率決定步驟。Li2S2形成的第二步是prN2摻雜的GNR速率決定步驟,能壘為0.30 eV。 進(jìn)一步構(gòu)建區(qū)域圖,以提供探測(cè)SRR機(jī)制的原則(圖4c–4e)。LiS3?、LiS2?和LiS?自由基在電催化劑上的吸附吉布斯自由能分別為ΔG(LiS3?*)、ΔG(LiS2?*)和ΔG(LiS?*)。η和相應(yīng)的速率決定步驟可從這三個(gè)描述符中得出。在對(duì)稱路徑中,η值由ΔG(LiS2?*)和ΔG(LiS?*)決定。得到的二維(2D)圖呈金字塔形狀,可分為四個(gè)區(qū)域,代表四個(gè)不同的速率決定步驟(圖4c)。具體來(lái)說(shuō),當(dāng)ΔG(LiS2?*)和ΔG(LiS?*)在區(qū)域1或2相交時(shí),η與ΔG(LiS2?*)呈現(xiàn)火山圖關(guān)系。當(dāng)ΔG(LiS2?*)比?2.23 eV更正時(shí),步驟1是電位限制步驟,而ΔG(LiS2?*)比?2.23 eV更負(fù)時(shí),步驟2是電位限制步驟。同樣,當(dāng)ΔG(LiS2?*)和ΔG(LiS?*)在區(qū)域3或區(qū)域4相交時(shí),催化活性可以用η與ΔG(LiS?*)相關(guān)聯(lián)的火山圖來(lái)描述。當(dāng)ΔG(LiS?*)比?2.18 eV更正時(shí),電位受到步驟3的限制。當(dāng)ΔG(LiS?*)比?2.18 eV更負(fù)時(shí),步驟4為電位限制步驟。二維圖中的連接點(diǎn)對(duì)應(yīng)兩個(gè)火山頂部η=0 V的點(diǎn),ΔG(LiS2?*)和ΔG(LiS?*)分別等于?2.23和?2.18 eV。如圖4c所示,prN2和gB摻雜的GNR在對(duì)稱路徑中的其他GNR中表現(xiàn)出最低的過(guò)電位(0.34 V),這得益于LiS2?(摻prN2和gB的GNR分別為?1.22和?1.17 eV)和LiS?(摻prN2和gB的GNR分別為?2.41和?1.99 eV)良好的折中。 在非對(duì)稱機(jī)制中,圖被繪制為ΔG(LiS3?*)、ΔG(LiS2?*)和ΔG(LiS?*)的函數(shù),表示為一個(gè)三維(3D)圖(圖4d)。類似地,給定催化劑的活性可以直接從3D圖中獲得。具體地說(shuō),速率決定步驟和η可以通過(guò)固定不同的描述符來(lái)實(shí)現(xiàn)。3D圖被分割成幾個(gè)2D圖,整合了其他兩個(gè)描述符(ΔG(LiS2?*)和ΔG(LiS?*))(圖4e)。通過(guò)2D圖中心部分的尺寸和顏色得到速率決定步驟和η,這取決于固定的ΔG(LiS3?*)。 對(duì)于摻雜了hO和eqN的GNRs,決定速率步驟是LiS2?*分解為L(zhǎng)iS?*,最大η分別為0.58和0.61 V。對(duì)于aO、pN、oB和egB摻雜的GNRs,決定速率步驟是Li2S2分解為L(zhǎng)iS?,最大η值分別為0.41、0.42、0.82和0.43 V。最大η由三個(gè)描述符控制(ΔG(LiS3?*)、ΔG(LiS2?*)和ΔG(LiS?*))。結(jié)果表明,在不對(duì)稱機(jī)制下,最佳的電催化劑應(yīng)具有理想的吸附吉布斯自由能平衡,對(duì)于ΔG(LiS3?*)、ΔG(LiS2?*)和ΔG(LiS?*)分別為?2.20、?2.25和?2.15 eV,從而產(chǎn)生較小的過(guò)電位。
05、成果啟示
本工作通過(guò)DFT計(jì)算系統(tǒng)地研究了鋰硫電池中的SRR機(jī)制,并建立了電催化模型來(lái)預(yù)測(cè)電催化劑的活性。在電催化模型中全面討論了對(duì)稱和不對(duì)稱機(jī)理。前者是指由Li2S4直接生成Li2S2,而后者則經(jīng)歷了有Li2S3的路徑。LiSy?自由基的吸附吉布斯自由能是確定SRR過(guò)電位和速率決定步驟的關(guān)鍵描述符。因此,綜合考慮了三個(gè)描述符(ΔG(LiS3?*)、ΔG(LiS2?*)和ΔG(LiS?*)),構(gòu)造了一個(gè)區(qū)域圖模型來(lái)可視化過(guò)電位和速率決定步驟。該研究在原子水平上建立了SRR電催化模型,加深了對(duì)SRR機(jī)理的理解,從而可以實(shí)現(xiàn)先進(jìn)SRR催化劑的合理設(shè)計(jì)。
審核編輯:郭婷
-
儲(chǔ)能系統(tǒng)
+關(guān)注
關(guān)注
4文章
833瀏覽量
24624 -
電池
+關(guān)注
關(guān)注
84文章
10465瀏覽量
129017
原文標(biāo)題:Angew:鋰硫電池中硫還原反應(yīng)的電催化模型
文章出處:【微信號(hào):清新電源,微信公眾號(hào):清新電源】歡迎添加關(guān)注!文章轉(zhuǎn)載請(qǐng)注明出處。
發(fā)布評(píng)論請(qǐng)先 登錄
相關(guān)推薦
實(shí)時(shí)原位監(jiān)測(cè)光電催化過(guò)程中反應(yīng)物濃度與熱效應(yīng)的微光纖傳感器技術(shù)
全固態(tài)鋰金屬電池的鋰陽(yáng)極夾層設(shè)計(jì)
固態(tài)電池中復(fù)合鋰陽(yáng)極上固體電解質(zhì)界面的調(diào)控

石墨負(fù)極在鋰離子電池中的發(fā)展與儲(chǔ)鋰機(jī)制
【大規(guī)模語(yǔ)言模型:從理論到實(shí)踐】- 每日進(jìn)步一點(diǎn)點(diǎn)
將廢正極材料升級(jí)為高穩(wěn)定性鋰硫電池的雙功能催化劑!

相調(diào)控對(duì)鎳錫合金的電催化氮還原調(diào)控機(jī)制研究
鋰亞電池和鋰錳電池的區(qū)別
鋰亞電池的應(yīng)用范圍有哪些
鋰亞電池的優(yōu)缺點(diǎn)有哪些
三元(P,Se,S)共價(jià)無(wú)機(jī)骨架作為鋰硫電池無(wú)穿梭效應(yīng)陰極




 基于系統(tǒng)密度泛函理論計(jì)算建立鋰硫電池中SRR的電催化模型
基于系統(tǒng)密度泛函理論計(jì)算建立鋰硫電池中SRR的電催化模型











評(píng)論