【研究背景】
電解液添加劑能夠有效提高鋰離子電池性能。目前,研究人員對添加劑(例如成膜劑)作用的認知有較大轉變,不僅會考慮添加劑在電極表面形成有效固體電解質界面膜(SEI)的作用,而且也會考慮添加劑改變溶劑化結構以及去溶劑化行為的作用(ACS Energy Lett. 2020, 4, 2613)。然而,添加劑是否具有其它未知的作用以影響電池性能,仍值得探索。本研究以硝酸鋰(LiNO3)添加劑為例,基于銻(Sb)負極,設計了一款新的醚基電解液,詳細闡述了添加劑對電解
液溶劑化結構及界面去溶劑化行為的影響。研究發現,LiNO3添加劑除了成膜以及影響電極界面去溶劑化過程中Li+-溶劑-陰離子配合物的熱力學和動力學性質外,還能夠調控Li+-溶劑-陰離子配合物與電極表面的距離,以調節電解液性質及電極的穩定性。
近期,中科院長春應化所明軍研究員、李茜特別研究助理對LiNO3添加劑的作用進行了再認識,首次在電極界面模型(去溶劑化過程)中引入了Li+-溶劑-陰離子配合物與電極表面之間的“距離”參量。研究發現,硝酸根(NO3-)能夠調控界面模型中Li+-溶劑-陰離子配合物與電極表面的距離,一定程度提高Li+-溶劑-陰離子配合物的穩定性,進而抑制電解液分解以及提高電極的穩定性。該研究以“Electrolyte Additive-Controlled Interfacial Models Enabling Stable Antimony Anodes for Lithium-Ion Batteries”為題發表在國際著名物理化學期刊The Journal of Physical Chemistry C上。本論文的第一作者蔡桃同學。 【內容表述】1. 研究主旨
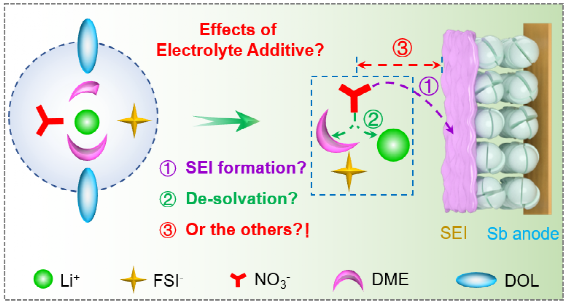
圖1. 添加劑在電極界面模型中的可能作用。
本研究探索了添加劑除了形成SEI膜、影響Li+溶劑化結構以及界面去溶劑行為以外的、未曾報道的可能因素,并揭示了其與電極性能的關系。(圖1)。
2. 電化學性能

圖2. 微米Sb負極電化學性能。
本研究設計了一款LiNO3添加劑修飾的、與微米Sb負極兼容的電解液,即3.0 M LiFSI/0.4 M LiNO3 in DOL/DME (1/1, v/v)。在該電解液中,Sb負極表現出664 mAh/g的比容量及82.5%的首次庫倫效率。0.1C電流密度,100次循環后比容量仍能保持在624mAh/g。相比之下,在沒有LiNO3添加劑的3.0 M LiFSI in DOL/DME電解液中,Sb負極在十幾個循環后就無法再正常充電。此外,將電解液濃度降低至1.0 M(即1.0 M LiFSI/0.4 M LiNO3 in DOL/DME)或使用LiTFSI鋰鹽(3.0 M LiTFSI/0.4 M LiNO3 in DOL/DME),Sb負極容量都急劇下降。以上結果表明,電解液的組分(如濃度、鋰鹽),尤其LiNO3添加劑的存在與否,能夠顯著影響Sb負極性能。
3. 電解液性質

圖3. 電解液表征。
電解液解析結果表明(圖3),NO3-與Li+具有較強的相互作用,能夠參與鋰離子第一溶劑化層,削弱Li+與DME的相互作用,進而促進Li+的去溶劑化。同時,與其他電解液相比,3.0 M LiFSI/0.4 M LiNO3 DOL/DME中的Li+與FSI-的相互作用最強。
4. 溶劑化結構及其界面模型
該研究采用Li+溶劑化結構模型及簡式(即Li+[solvent]x[additive]yanion])建立Sb負極表面的Li+去溶劑化過程,即電極界面模型。在3.0M LiFSI/0.4 M LiNO3 in DOL/DME(即Li+[DME]1.41[DOL]2.11[FSI-]0.88[NO3-]0.12)電解液中,溶劑不足以將Li+、FSI-和NO3-充分溶劑化,使得劑化層共享溶劑而相互重疊。與DOL溶劑相比,DME溶劑與Li+配位的能力較強,主導界面DME溶劑對Li+的影響。與其他三種電解液相比,NO3-的存在以及較高的鋰鹽濃度,使得Li+/FSI-的相互作用最強,Li+-DME相互作用最弱,Li+更容易在電極表面去溶劑化。尤其,Li+/FSI-和Li+/NO3-較強的相互作用,會在一定程度上中和Li+的正電性,減弱電極對Li+的吸引,使得Li+-DME-陰離子配合物距離電極表面相對較遠(U1)。因此,即使Li+-DME-陰離子配合物的熱穩定性較低,電解液仍具有良好的電化學穩定性(圖4)。

圖4. 溶劑化結構及界面模型。
在無LiNO3的3.0M LiFSI in DOL/DME(即Li+[DME]1.61[DOL]2.40[FSI-])電解液中,DOL/DME溶劑相對充足,溶劑化層重疊程度減少,Li+/FSI-相互作用減弱,溶劑占主導電極界面。雖然3.0M濃度相對較高,FSI-仍能出現在電極表面,但是LiNO3的缺失使得Li+/FSI-作用強度不足以削弱Li+/DME的相互作用,Li+難以去溶劑化。同時,LiNO3的缺失不能削弱Li+-DME配合物的正電性,使得Li+-DME配合物距離電極表面較近(U2),即使Li+-DME的ΔE值較高,仍難以避免嚴重的溶劑分解。當LiFSI濃度降低到1.0 M時,溶劑數量充足,DME和DOL分別占據第一和第二溶劑化層,溶劑主導Sb負極界面。盡管如此,NO3-體積小且與Li+強的配位作用,使其仍有機會在電極界面削弱Li+/DME的相互作用,使Li+-2DME-NO3-配合物與電極保持較遠距離(相較于Li+-DME,U3 》 U2)。因此,即使Li+-2DME-NO3-配合物ΔE值低,仍能一定程度抑制電解液分解。LiNO3削弱Li+/DME的相互作用,改變界面模型的作用在3.0 M LiFTSI/0.4 M LiNO3 in DOL/DME (即Li+[DME]1.41[DOL]2.11[TFSI-]0.88[NO3-]0.12)電解液中,進一步得到了驗證。與LiFSI-基電解液相似,溶劑不夠,劑化層會共享溶劑而相互重疊。與Li+/FSI-相比,Li+/TFSI-相互作用弱,溶劑主導Sb界面。盡管Li+-DME和Li+-DME-TFSI-的ΔE值相對較高,但Li+-DME和Li+-DME-TFSI-距離電極相對LiFSI基電解液近(Li+-DME-FSI-, U4 《 U1),因此仍能觀察到電解液的緩慢分解。以上研究結果表明,添加劑能夠改變Li+溶劑化結構及其界面模型,促進Li+的去溶劑化,尤其揭示了除了ΔE之外,Li+-溶劑-陰離子配合物距離電極表面的“距離”也是影響電解液及電極穩定性的一個關鍵因素。
5. 電極及SEI膜的表征

圖5. 電極及SEI膜的表征。
循環后Sb負極的表征進一步驗證了LiNO3作用以及界面模型的準確性(圖5)。結果表明,在3.0M LiFSI/0.4 M LiNO3 in DOL/DME電解液中循環后,Sb負極整體結構保存相對完整,SEI膜富含LiF和LiN3且有機物含量低,具有高的機械強度和化學穩定性,可以有效穩定Sb負極。此外,該循環后Sb負極的電荷轉移電阻僅為8.4 Ω。上述結果表明,LiNO3添加劑能夠調節微米Sb負極表面電解液分解路徑及程度,從而穩定電解液及Sb負極,與界面模型分析一致。
6. 電解液交換實驗
本文通過“交換實驗”進一步證明了LiNO3添加劑在穩定電解液及電極穩定性中的關鍵作用(圖6)。實驗結果表明,LiNO3參與形成的SEI對維持Sb負極穩定性的作用是有限的。如果電解液與Sb負極不兼容,SEI則無法緩解電解液的分解。因此,LiNO3參與調控的溶劑化結構和界面模型,尤其Li+-溶劑-陰離子配合物與電極界面的距離,才是決定電解液穩定性和Sb負極性能的關鍵因素。
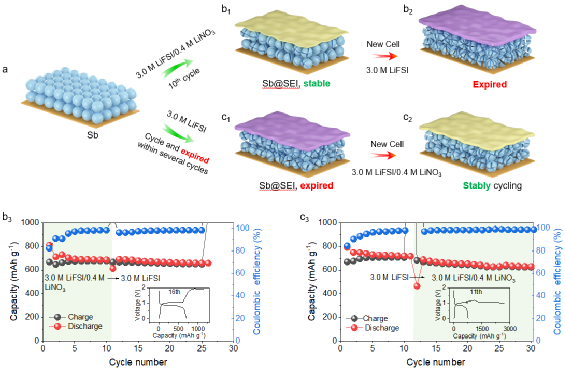
圖6. 電解液交換實驗。
7. 鋰離子全電池應用
該研究以微米Sb為負極,NCM622為正極,3.0 M LiFSI/0.4 M LiNO3 in DOL/DME為電解液組裝了鋰離子全電池(圖7),進一步證明了Sb負極在該電解液中的高穩定性。該電池在0.2C(1C = 180 mA/g)電流密度下表現出了良好的循環性能,經100次循環,容量容量未發生明顯衰減。此外,在0.1、0.2、0.5、1和2 C電流密度下,容量分別為137、132、123、112和101 mAh/g,表明了全電池具有優異的倍率性能。

圖7. 全電池性能。
【結論】
該工作設計了一款新的LiNO3添加劑修飾的醚基電解液以穩定Sb負極,并獲得了優異的電化學性能。研究發現,LiNO3添加劑不僅能削弱Li+/DME的相互作用,調節Li+溶劑化結構,影響去溶劑化過程中Li+-溶劑-陰離子配合物的動力學和熱力學性質,尤其還能影響去溶劑化過程中Li+-溶劑-陰離子配合物與電極表面的“距離”。該研究首次提到LiNO3添加劑調控的界面模型中Li+-溶劑-陰離子配合物與Sb負極表面的“距離”,是影響電解液及電極穩定性的一個關鍵因素。該工作從不同的視角解析了LiNO3在調節Li+溶劑化結構和衍生的界面模型方面的重要性,為穩定金屬離子電池中的合金負極極及其他電解液設計提供了指導。審核編輯:郭婷
-
鋰離子電池
+關注
關注
85文章
3215瀏覽量
77555 -
電極
+關注
關注
5文章
807瀏覽量
27165 -
電解液
+關注
關注
10文章
840瀏覽量
23067 -
電池
+關注
關注
84文章
10473瀏覽量
129037
原文標題:應化所李茜/明軍研究員電解液添加劑篇:再識硝酸根作用,別忘了距離
文章出處:【微信號:清新電源,微信公眾號:清新電源】歡迎添加關注!文章轉載請注明出處。
發布評論請先 登錄
相關推薦
電解電容正負極判斷 電解電容的作用是什么
貼片電解電容正負極判斷方法
鎳氫電池的電解液是什么
電解電容的正負極怎么區分
高壓電解電容虛標原因,高壓電解電容虛標怎么判斷
新宙邦擬在美國投建10萬噸/年電解液項目
用于延長高壓高Ni三元鋰金屬電池壽命的無氟醚基電解液





 基于銻負極實現新的醚基電解液的設計
基于銻負極實現新的醚基電解液的設計













評論