藥物篩選是藥物發現的關鍵步驟,當前的藥物篩選大多數是基于單一作用靶標的單藥物篩選,靶細胞(腫瘤細胞)一旦產生耐藥性,針對單一作用靶標的單一藥物對腫瘤細胞的殺傷性就會大大削弱。
而人體疾病的產生和發展往往伴隨著復雜的基因通路的改變,相比于單藥物,多重藥物可以通過作用于多個通路的多個靶標從而發揮更好的治療效果,有著可降低耐藥性和疾病復發可能性的優勢。
然而,由于待檢測藥物組合數量巨大,并且現有的基于細胞形態或細胞增殖率的表型分析策略相對簡單,導致目前已知的有效的藥物組合較少。
近期,深圳大學李自達助理教授與深圳市華大生命科學研究院劉亞副研究員合作,完成了利用單細胞測序和微液滴操控、實現高通量多重藥物篩選的工作。相關研究成果于近日以“Combinatorial perturbation sequencing on single cells usingmicrowell-based droplet random pairing”為題發表在Biosensors& Bioelectronics上。
該項工作得到國家重點研發計劃、廣東省自然科學基金、深圳市海外高層次人才科研啟動經費和深圳大學青年教師科研啟動經費的資助。
在該研究中,研究團隊使用基于微孔的液滴隨機配對實現對單個細胞的組合擾動并測序(CP-seq),通過在組合藥物處理下的單細胞轉錄組的變化來表征組合藥物對單細胞的基因擾動情況。
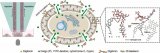
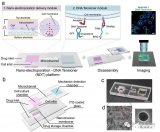
CP-seq利用連接了刀豆蛋白的寡核苷酸對藥物進行編碼(圖1a),將藥物和細胞分別封裝在不同的液滴中(圖1b),在微孔陣列芯片上將細胞液滴與兩個藥物液滴隨機配對,從而完成對細胞的組合藥物處理和編碼標記(圖1c)。
在隨后的單細胞轉錄組測序中可以同時檢測單細胞的轉錄組信息和藥物編碼,用于解碼相應的藥物處理條件(圖1d)。
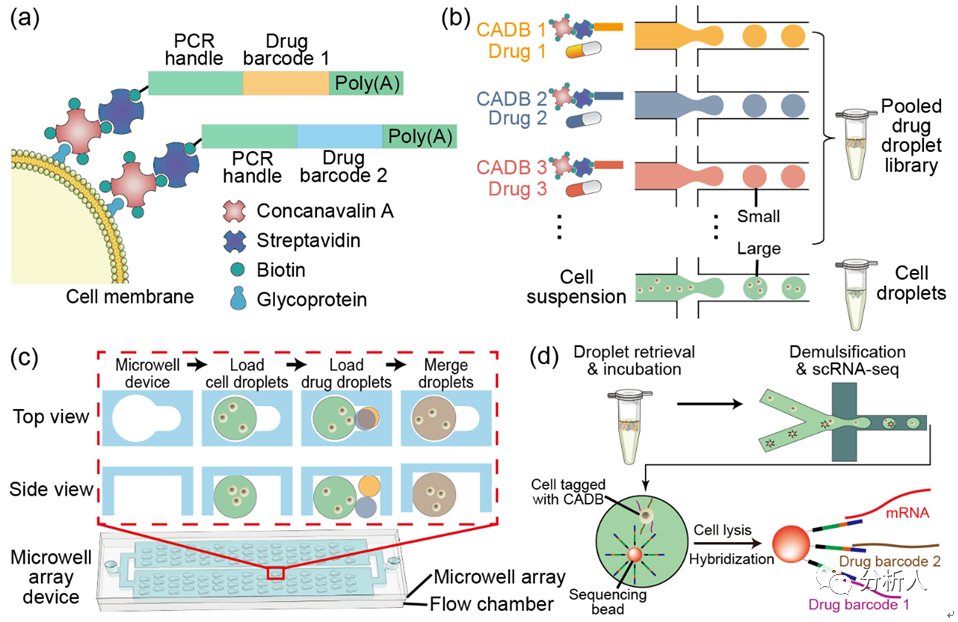
圖1 CP-seq流程示意圖。(a)連接有寡核苷酸序列(藥物編碼)的刀豆蛋白對細胞進行標記;(b)細胞液滴的生成和藥物液滴池的生成與集合;(c)在微孔陣列上實現細胞液滴和隨機的組合藥物液滴的捕獲、配對及融合;(d)融合后的液滴進行回收孵育后,液滴破乳回收經過組合藥物處理后的被標記的細胞來進行單細胞測序,測序磁珠通過poly(T)尾巴同時捕獲mRNA和藥物編碼。
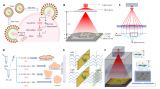
對液滴的穩定***是CP-seq技術的基礎。因此,研究團隊首先通過系列實驗優化和表征了高度穩定的液滴微流控***性能。研究團隊利用注射器施加負壓的方式可穩定生成尺寸可控的包裹不同內容物的液滴(變異系數小于5%),并且在使用8000/μL的細胞密度下有著超高的細胞液滴利用率(97.9%的細胞液滴包裹至少一個細胞)。在液滴配對過程中,藥物液滴的尺寸是一個重要的參數。例如,當藥物液滴的直徑為50μm而不是43μm時,只有20.4%的微孔捕獲了兩個藥物液滴,77.7%的微孔捕獲了一個藥物液滴。
在液滴捕獲、配對和融合過程中,高達83%的微孔利用率表現出CP-seq平臺良好的微流控液滴***性能。最后,研究團隊進行了電暈處理實現液滴融合的方式對細胞基因表達影響的探究,通過與對照組的UMAP聚類圖比較,發現電暈處理對細胞基因表達的影響可忽略不計。
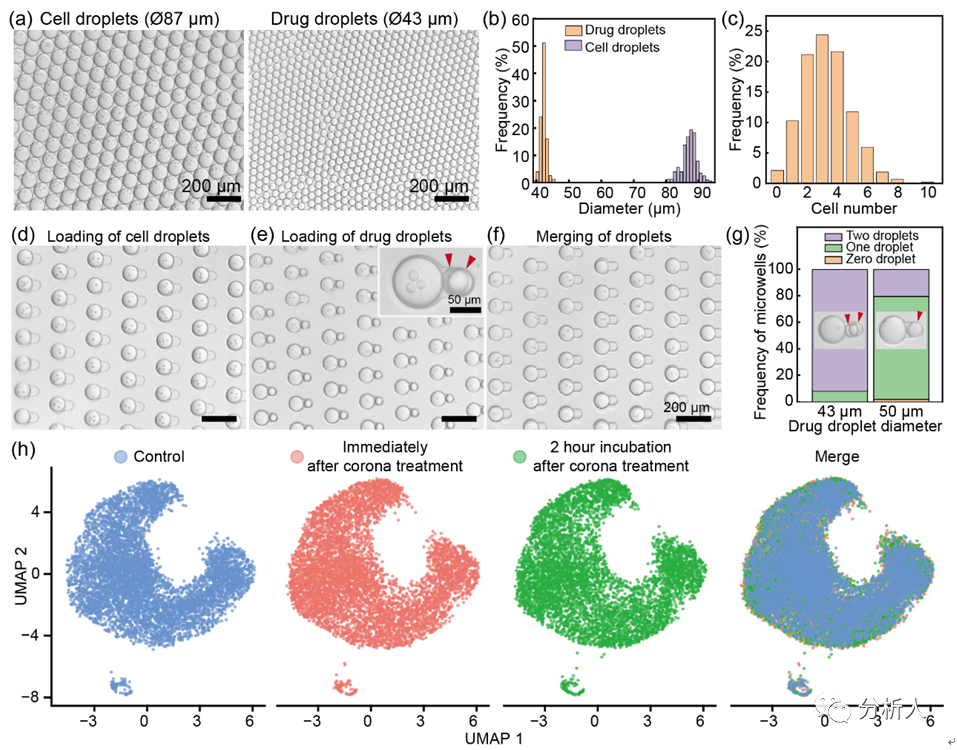
圖2 液滴微流控的平臺性能表征。(a-b)細胞液滴和藥物液滴的顯微圖片和直徑分布直方圖;(c)每個細胞液滴內細胞個數的分布;(d-f)細胞液滴的捕獲、藥物液滴的捕獲和液滴融合的顯微圖片,每個過程中的微孔利用率分別為99%、92%和90%;(g)不同尺寸的藥物液滴在藥物液滴捕獲過程中的差異;(h)單細胞測序數據的UMAP聚類圖展示電暈處理對細胞基因表達的影響。
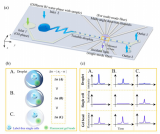
在驗證CP-seq具有良好的液滴***性能后,鑒于經過選定的藥物單獨處理后的細胞的基因表達已經有廣泛的研究,可以作為參考的標準,因此研究團隊通過進行單藥物處理來驗證CP-seq的可靠性。通過對細胞進行不同孵育時間(4、8、12小時)的單藥物處理(3種不同濃度的4種藥物以及1組空白對照),研究團隊發現不同孵育時間下的細胞的基因表達具有顯著差異。
并且,隨孵育時間的提高,選定的抗癌藥物的目標基因的表達量的變化趨勢和過往文獻中報導的一致,充分證明了CP-seq平臺在單藥物處理中的良好的可靠性。
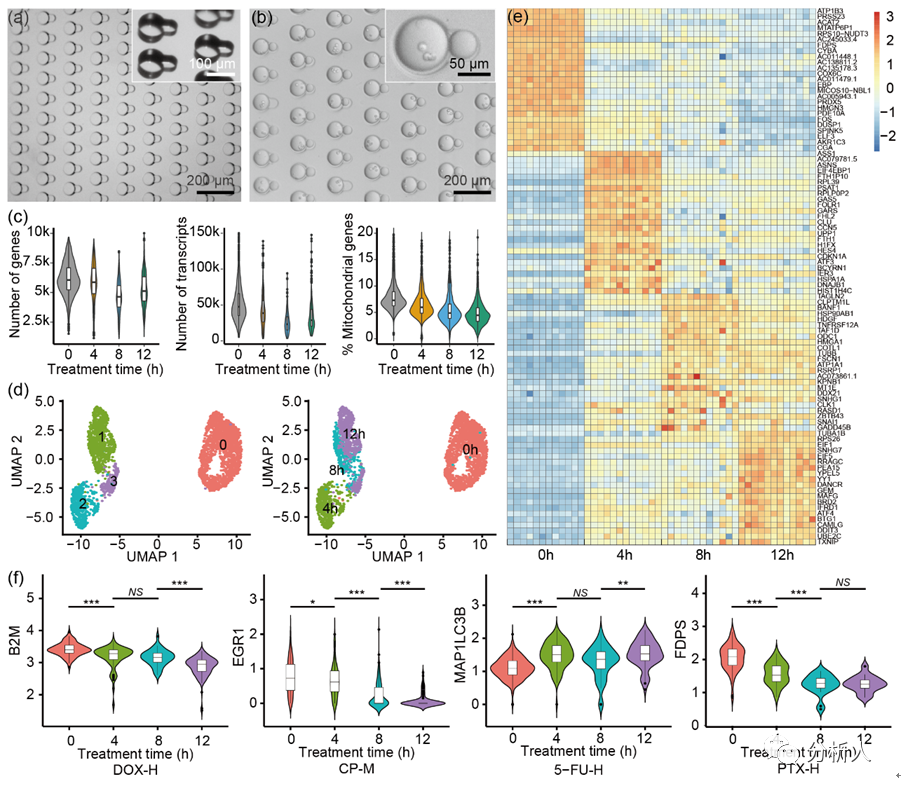
圖3 通過單藥物處理驗證CP-seq的可靠性。(a)用于捕獲單一藥物液滴的微孔陣列芯片,大小孔具有不同的深度;(b)捕獲了細胞液滴和單一藥物液滴的顯微圖片;(c)在0、4、8和12小時的藥物處理條件下,對單細胞測序結果進行質量控制;(d)UMAP聚類散點圖;(e)不同孵育時間下基因表達的熱圖,每列代表相應孵育時間下的藥物處理條件;(f)代表性基因在不同藥物孵育時間下的基因表達變化。
最后,研究團隊實施CP-seq的完整流程以進行進一步的驗證。13種藥物條件中的兩種可能的組合數量為78種。在非孵育組,共回收出71種藥物組合(圖4a),缺少的七種組合可能是在數據過濾中由于質控不合格而被剔除。在孵育組***回收了47種藥物組合,這些組合的數量比非孵育組少,可能是由于組合藥物處理誘導細胞死亡。
研究團隊接著通過對細胞組分的基因富集分析來得到這兩個實驗組之間細胞組分的差異。結果表明,未進行孵育組中富集到的基因類別主要與細胞核中的染色體有關,其基因具有有絲分裂等功能(圖4b)。相比之下,組合藥物孵育1小時組富集的基因類別主要是核糖體和線粒體成分,可能表明高細胞正處于高度應激狀態。
然后,研究團隊將組合藥物處理1小時與單一藥物處理4、8、12小時的轉錄組信息做比較,并通過火山圖展示(圖4c),其中,MALAT1、NEAT1和B2M等基因的差異表達充分證明CP-seq在組合藥物處理下分析細胞的轉錄組信息的能力。
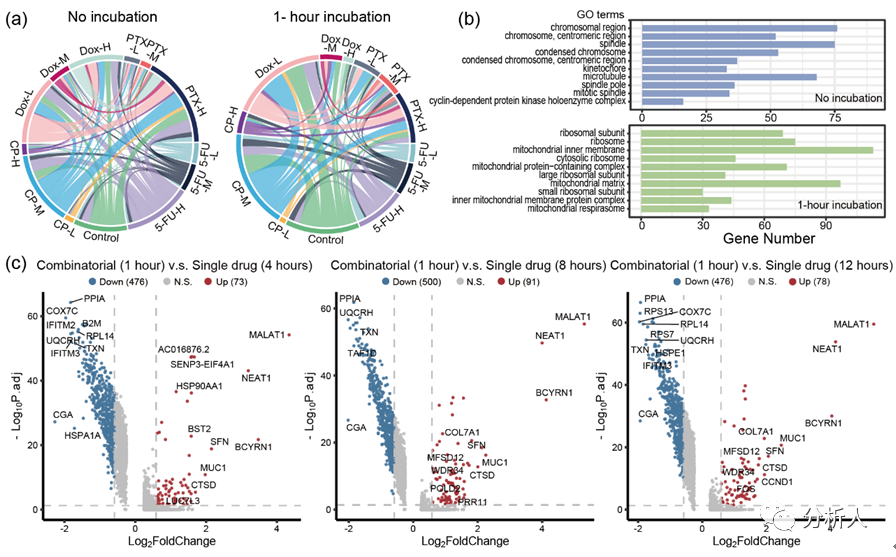
圖4 通過組合藥物處理驗證CP-seq的可靠性。(a)和弦圖展示單細胞測序數據中回溯出的藥物組合情況,分為未孵育組和組合藥物孵育1小時組;(b)未孵育組和組合藥物孵育1小時組的細胞組分的基因富集分析;(c)火山圖表示組合藥物孵育一小時的細胞與單藥物孵育 4 小時、8 小時和 12 小時的差異基因表達的比較。
綜上所述,實驗中使用的載玻片大小的微孔陣列芯片大約有26800個微孔單元,每個微孔平均可容納3個細胞,在20個微孔的樣本大小(~60個細胞)情況下,一張芯片原則上可以同時進行1300種藥物組合的處理。除了兩種藥物的組合外,在每個微孔單元中加入額外的小微孔,CP-seq就具有適用于測試多種藥物組合的潛力。因此,利用液滴微流控在高通量篩選中的優勢,CP-seq可以在一次實驗中測試數千種藥物組合,有望成為一種用于高通量和深入分析的組合藥物篩選新技術,極大地促進新藥物組合的發現。
論文鏈接: https://doi.org/10.1016/j.bios.2022.114913
審核編輯:劉清
-
微流控芯片
+關注
關注
13文章
267瀏覽量
18814
原文標題:基于液滴微流控的單細胞測序技術,實現高通量多重藥物篩選
文章出處:【微信號:Micro-Fluidics,微信公眾號:微流控】歡迎添加關注!文章轉載請注明出處。
發布評論請先 登錄
相關推薦
使用原代腫瘤細胞進行藥物篩選的數字微流控系統
高通量生物分析技術之微流控芯片
華大發布兩款納米孔測序儀
中國移動浙江公司攜手華為完成5G-A高通量UPF全球現網首呼
采用集成光子技術的片上流式細胞儀,瞄準高通量細胞分析

賦能產業互聯網,高通量計算讓世界更高效!

基于雙極性電極陣列的微流控芯片,可實現細胞可控、非接觸三維旋轉

熒光顯微鏡細胞圖像檢測實戰
東南大學在釀酒酵母單細胞復制衰老壽命圖像分析算法方面取得進展




 單細胞測序技術實現高通量多重藥物篩選
單細胞測序技術實現高通量多重藥物篩選










評論