血腦屏障(BBB)是指調節血液和大腦之間分子交換的物理和代謝屏障,主要由高度特化的內皮細胞、周細胞和星形膠質細胞的足部組成。對于大多數中樞神經系統疾病(包括腦癌、中風、自閉癥和阿爾茨海默病)的治療,藥物的療效往往有限,這是由于藥物通過血腦屏障的穿透力差。
不幸的是,動物模型通常在屏障緊密性、轉運蛋白表達和代謝活性方面表現出物種差異。因此,動物模型的預測結果不能直接外推到人類身上。此外,動物實驗成本高,耗時長,藥物的高通量篩選和機制研究很難在動物模型上進行。因此,迫切需要開發替代模型來更好地預測血腦屏障的藥物滲透性,促進神經治療的發展。
最常用的體外血腦屏障模型是在Transwell上培養一層腦微血管內皮細胞(BMECs)。然而,Transwell的這種靜態培養缺乏機械力,保持了較大的液細胞體積比,導致細胞環境中的信號不穩定和不可控。此外,流體剪切應力作用于BMECs,對細胞生長、屏障功能、轉運蛋白表達和藥物滲透性有顯著影響。與基于Transwell的體外血腦屏障模型相反,器官芯片(Organ-on-a-chip,OOC)技術是一種構建血腦屏障模型的動態培養平臺,具有可控的生化和生物力學微環境的優勢。
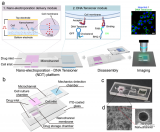
近日,北京大學艾曉妮、屠鵬飛團隊設計了一個高通量恒速率灌注陣列芯片(cPAC),并基于該芯片構建了用于藥物滲透性篩選的血腦屏障器官芯片模型。該成果以“Constant-rate perfused array chip for high-throughput screening of drug permeability through brain endothelium”為題,發表在英國皇家化學會期刊Lab on a Chip上,并入選為期刊的封底文章。
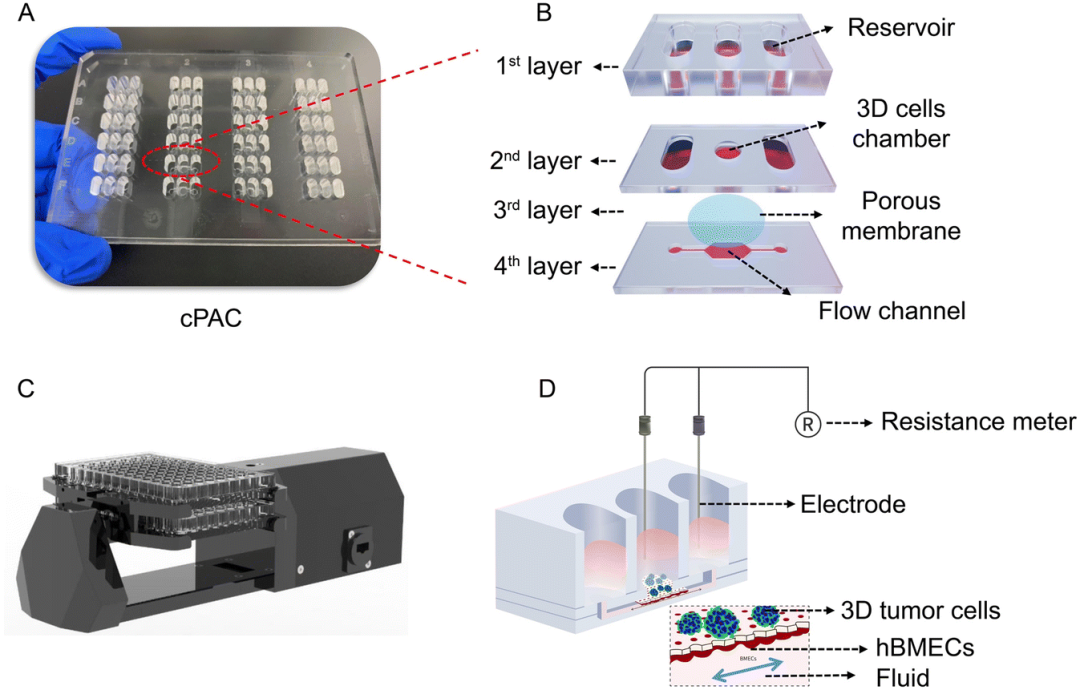
恒速率灌注陣列芯片(cPAC)的照片和原理圖
研究結果表明,該恒速率灌注陣列芯片能通過重力作用實現恒流、高通量的灌注;同時兼容跨膜電阻儀,可實現屏障功能的實時監測。
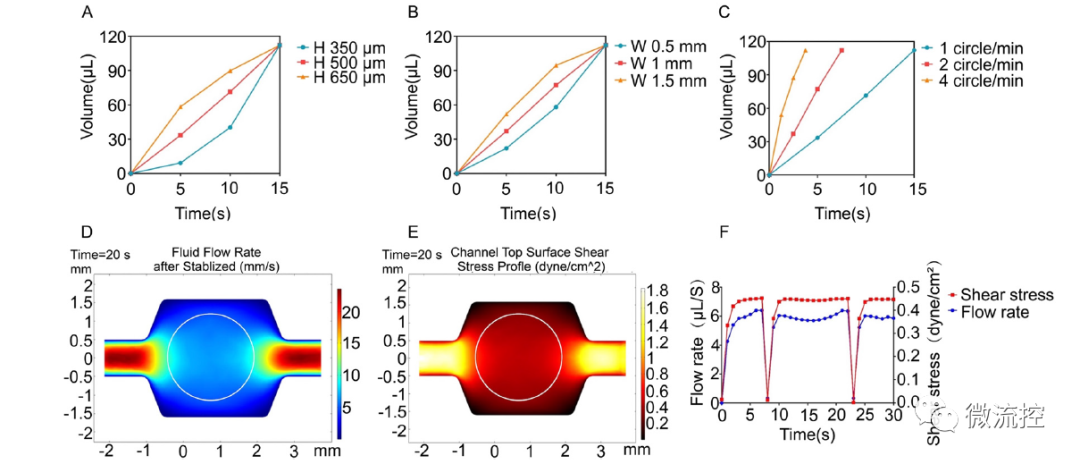
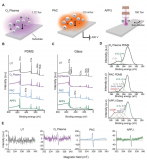
恒速率灌注陣列芯片(cPAC)上流體流速和剪切應力的表征
與靜態Transwell培養的血腦屏障模型相比,高仿生血腦屏障器官芯片模型具有更強的屏障、轉運外排和可逆滲透功能。
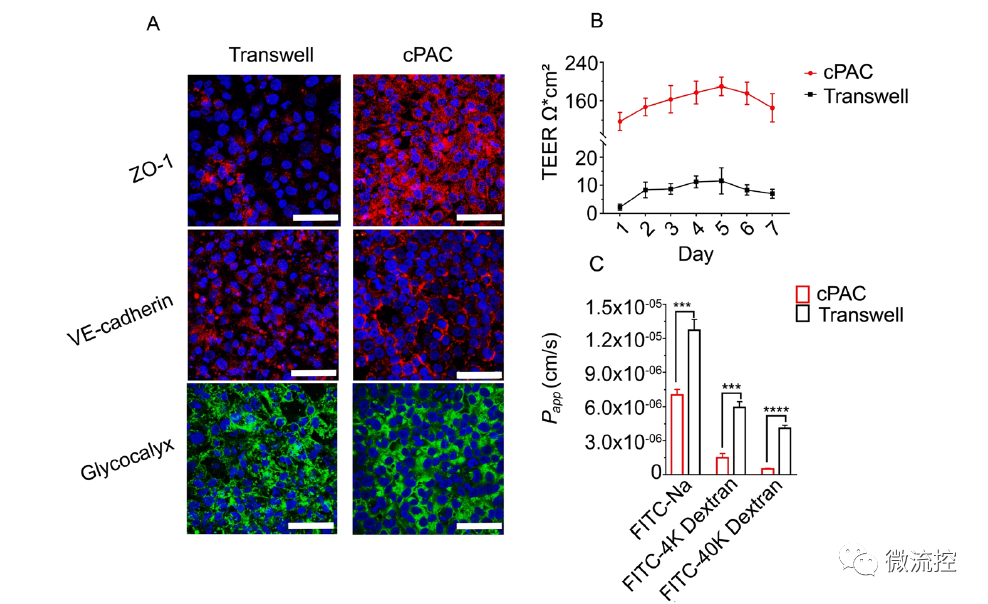
恒速率灌注陣列芯片(cPAC)和Transwell培養的腦內皮細胞模型屏障功能的比較
此外,研究結果表明,不同藥物在血腦屏障器官芯片模型上的透腦能力(Papp)與體內具有極高的一致性,相關系數R2大于0.99。
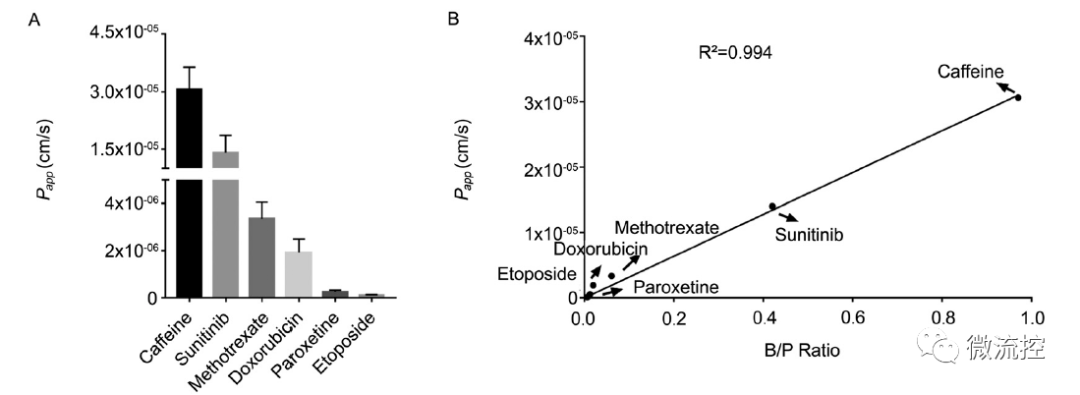
體外模型與體內模型藥物透腦能力的相關性
在此基礎上,研究人員構建了血腦屏障-腫瘤串聯器官芯片模型,可以同時評價藥物的透腦能力和抗腦腫瘤藥效,對TKI抑制劑治療肺癌腦轉移的預測結果與體內模型高度一致。
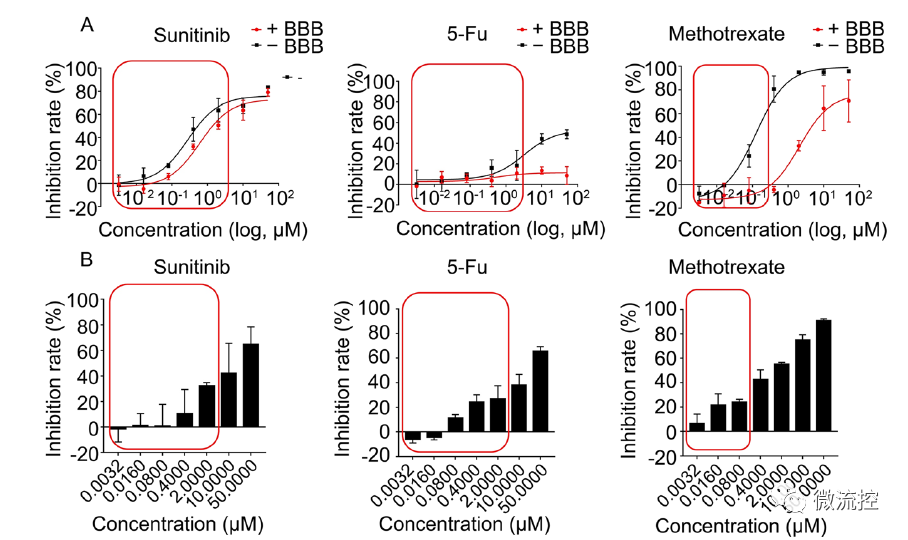
同時評價模型藥物對人腦微血管內皮細胞(hBMECs)的透過性、抗膠質瘤療效和細胞毒性
綜上所述,該研究開發的恒速率灌注陣列芯片和血腦屏障模型為創新藥物的透腦能力評價和機制研究提供創新技術平臺,有望加速中樞神經系統藥物研發,目前已在北京大橡科技有限公司應用轉化。
審核編輯:劉清
-
神經系統
+關注
關注
0文章
83瀏覽量
12983
原文標題:仿生高通量血腦屏障器官芯片,實現高效藥物透腦能力評價
文章出處:【微信號:Micro-Fluidics,微信公眾號:微流控】歡迎添加關注!文章轉載請注明出處。
發布評論請先 登錄
相關推薦
芯片上集成功能性血管化類器官的微流控平臺
使用原代腫瘤細胞進行藥物篩選的數字微流控系統
接口芯片的編程模型方法是什么
石墨烯基導電油墨具有良好的滲透性和低阻抗,針對 RFID天線性能進行了優

利用微流控技術制備的“心臟顆粒”,用于評估藥物的心臟毒性
谷歌DeepMind推出新一代藥物研發AI模型AlphaFold 3
mapgis屬性篩選表達式
英飛凌在浦東打造“數字+低碳”現代智能化倉庫,漢威科技為電池安全保駕護航
新能源車將突破2000萬輛,三星希望通過華星光電間接控制 LG 顯示廣州工廠
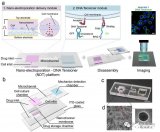




 用于藥物滲透性篩選的血腦屏障器官芯片模型
用于藥物滲透性篩選的血腦屏障器官芯片模型










評論