外泌體(exosomes,EXOs)是一種直徑在40 nm-200 nm之間的具有磷脂雙分子層結構的囊泡。目前,科研人員已經從各種體液,如精液、血液、尿液、唾液、母乳、羊水、腹水、腦脊液以及膽汁中分離出了具有外泌體特征的囊泡。同時,外泌體作為一種功能性的囊泡,包含了豐富的來自母體細胞的分子信息,例如DNA、RNA、脂質、代謝物、細胞質以及蛋白等,引起了科研人員的廣泛興趣。然而,外泌體作為一種納米尺寸的柔性顆粒,且所處體液環境組成復雜,因此,實現外泌體準確無損的無標簽分離一直是外泌體研究領域發展的瓶頸。
切向流過濾(TFF)技術是過濾技術的一種,當分離液體移動方向與過濾方向垂直,一部分液體將會透過分離介質,截流的顆粒在分離界面上不斷被新補充的液體掃除,降低了節流顆粒在膜表面的積累,使其一直處于高效的過濾模式,因此,TFF在生物分子分離上有著獨特的優勢。外泌體等柔性囊泡在使用TFF方法進行分離時由于不直接受到流體的擠壓,而是通過輕柔的切向作用流過分離界面,極大地減小了對外泌體等柔性結構的破壞,保證了其完整性。同時,前期報道的單層TFF分離作用有限,往往需要進行高速離心等預處理步驟。因此,有必要發展一種雙層TFF過濾設備用于外泌體的高效分離與富集。
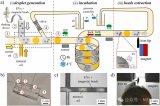
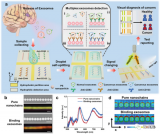
近日,東南大學劉松琴教授團隊在國際期刊Analytica Chimica Acta上發表了題為“A double tangential flow filtration-based microfluidic device for highly efficient separation and enrichment of exosomes”的研究論文。該研究設計了一種基于雙切向流(DTFF)的微流控分離裝置,結合雙切向技術與兩種孔徑的納米多孔膜,實現對30 nm-200 nm區間外泌體的高效分離與富集。利用該芯片分離肝疾病患者血清中的外泌體,并進行蛋白組學分析,得出了外泌體表達的差異蛋白,為肝臟相關疾病的診斷提供了新思路。文章通訊作者為東南大學劉松琴教授,第一作者為東南大學華鑫博士與研究生朱倩。

該論文首先搭建了一種基于雙切向流的微流控裝置,雙層的TFF構造為尺寸分布不夠均勻的生物囊泡分離提供了可靠的方法,通過構建兩種不同尺寸的分離界面,可以限定待分離生物囊泡的上下限,將大于該區間的物質攔截,小于該區間的物質通過流體流動分離;同時,雙層TFF作用相較于單層TFF,其壓力更小,對于維持囊泡的完整性上更具優勢。
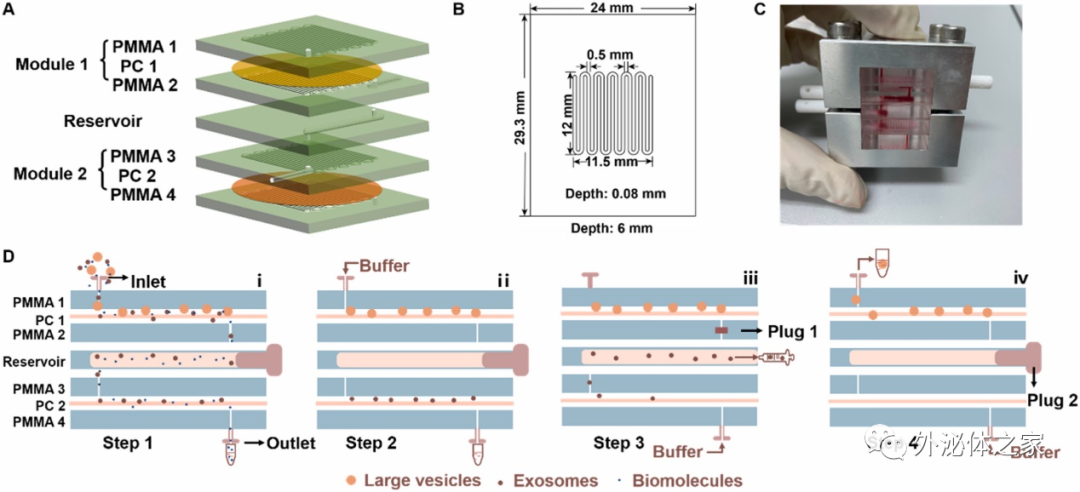
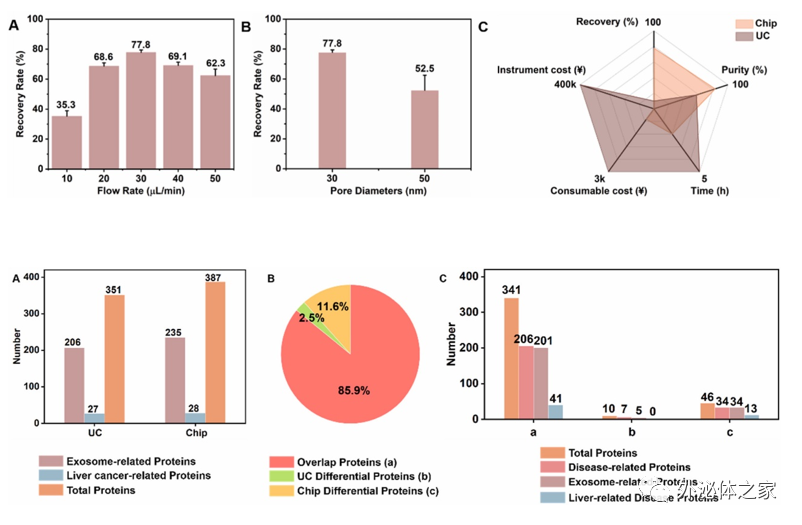
將該方法與傳統外泌體分離方法-超速離心法進行對比,芯片分離在耗時、純度、回收率、耗材耗費以及設備耗費上均優于超速離心法。進一步用芯片與超速離心兩種方法分離肝疾病患者血清中的外泌體,并進行蛋白組學分析,芯片分離出的血清外泌體純度高于超速離心法得到的外泌體,并在蛋白組學分析中展現了更多的差異蛋白,為疾病相關外泌體的研究及臨床應用提供了新的方法。
論文鏈接:
https://doi.org/10.1016/j.aca.2023.341160
審核編輯 :李倩
-
芯片
+關注
關注
454文章
50460瀏覽量
421980 -
裝置
+關注
關注
0文章
341瀏覽量
21500 -
微流控
+關注
關注
16文章
513瀏覽量
18863
原文標題:基于雙切向流的微流控分離裝置,實現外泌體的高效分離與富集
文章出處:【微信號:Micro-Fluidics,微信公眾號:微流控】歡迎添加關注!文章轉載請注明出處。
發布評論請先 登錄
相關推薦
Aigtek高壓放大器在介電泳的微流控細胞分離技術中的應用
S型微流控芯片的優勢
微流控陣列芯片和普通芯片的區別
COC/COP微流控芯片開發與應用
讀寫分離怎么保證數據同步
讀寫分離解決什么問題
武漢大學:研究微流控電化學集成傳感器,快速、高效分離和靈敏檢測致病菌
淺談微流控芯片技術





 基于雙切向流的微流控分離裝置,實現外泌體的高效分離與富集
基于雙切向流的微流控分離裝置,實現外泌體的高效分離與富集











評論