據統計,2021年全球約有5.37億成年糖尿病患者,并有超過670萬人死于糖尿病,且預計到2045年,全球糖尿病患者數量將達到7億。目前治療糖尿病的手段主要有兩種:人工注射胰島素和口服降糖藥。口服降糖藥容易讓患者產生依賴性,從而使得藥物的有效性和安全性較低;但是,直接注射胰島素則容易出現低血糖和體重增加等問題,并且一天多次的注射過程會讓患者飽受痛苦,從而導致患者的依從性不高。為了減少頻繁注射以及達到更好的血糖控制效果,無創給藥以及智能釋放的方式受到了廣泛關注。
近年來,微針(MN)貼片這種無痛的給藥方式已經在美容領域得到應用。微針貼片由數十到數百根長度為數百微米的細針陣列組成,透皮時幾乎沒有痛覺,也不會留下明顯創口,是一種理想的透皮給藥方式。微針可以分為實心微針、涂層微針、空心微針、水凝膠微針和可溶性微針等。可溶性微針因為制備過程相對簡單、載藥量高、材料來源廣、生物相容性好等優勢在透皮給藥方面具有良好的研究潛力,其中的藥物被集成到微針的針體內,并隨著微針的溶解而釋放,藥物利用率高,且不產生醫療廢物。然而,如果僅僅是將胰島素集成到可溶性微針上,雖也能提高糖尿病患者的用藥舒適性,卻無法避免低血糖風險和頻繁給藥的麻煩。
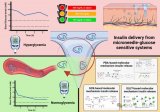
據麥姆斯咨詢報道,近期,來自暨南大學的研究人員設計制備了一種基于透明質酸的可溶性微針,并通過負載礦化胰島素(m-INS)和礦化葡萄糖氧化酶(m-GOx)進一步構建了一個智能給藥系統,可以實現血糖濃度信號的自主識別,并控制胰島素的釋放行為,以維持血糖正常,并最終實現糖尿病的有效治療,具有廣闊的臨床應用前景。相關研究成果以“透明質酸微針經皮遞送胰島素智能給藥系統用于糖尿病治療”為題發表在《生物工程學報》期刊上。
載藥微針的制備
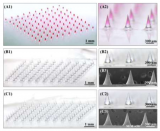
該研究制備的透明質酸(HA)微針陣列的體視顯微鏡照片和電子顯微鏡照片分別如圖1A和1B所示,微針針體飽滿、形狀均一,針體高約730 μm、底寬約356 μm,針尖直徑約30 μm。隨后,研究人員用萬能試驗機對透明微針的機械強度進行了檢測,結果顯示,每根微針能承受約0.33 N的力,與合成的聚合物微針機械強度相當,足夠刺穿皮膚。隨后,研究人員利用礦化胰島素和礦化葡萄糖氧化酶,制備獲得了載藥透明質酸微針貼片。萬能試驗機的檢測結果顯示,載藥微針的機械強度提高到了0.43 N/針。接著,研究人員分別用FITC和Cy5對胰島素和葡萄糖氧化酶進行了標記,并隨后按照同樣步驟制備獲得了載藥透明質酸微針。將獲得的載藥微針在倒置熒光顯微鏡下進行觀察,結果如圖1C-1E所示,微針針體飽滿、形態規則,在488 nm激發波長下能看到強烈的綠色熒光,而在546 nm激發波長下能看到強烈的紅色熒光,表明FITC-礦化胰島素和Cy5-礦化葡萄糖氧化酶在微針中分布均勻。

圖1 微針顯微照片:(A)體式顯微鏡下的透明質酸(HA)微針;(B)掃描電子顯微鏡下的透明質酸(HA)微針;(C-E)同時負載FITC-礦化胰島素(m-INS)和Cy5-礦化葡萄糖氧化酶(m-GOx)的透明質酸(HA)微針
載藥透明質酸微針的血糖調控能力
隨后,為了評價載藥透明質酸微針對血糖的調控能力,研究人員選用4 ~ 6周齡雄性SD大鼠,并按照55 mg/kg的量經腹腔注射鏈脲佐菌素(STZ)以建立1型糖尿病大鼠模型。研究結果顯示,注射后大鼠的血糖持續升高,10 d后平均血糖穩定在21.7 mmol/L左右,明顯高于3.9 mmol/L ~ 6.1 mmol/L的正常范圍,證明成功構建了1型糖尿病SD大鼠模型。
接著,研究人員將糖尿病大鼠隨機分為4組,每組3只,并分別將空白透明質酸微針、負載胰島素的微針、負載礦化胰島素的微針以及同時負載礦化胰島素和礦化葡萄糖氧化酶的微針貼在大鼠皮膚表面。如圖2C所示,空白透明質酸微針組和負載礦化胰島素的微針組的大鼠血糖濃度幾乎不變,而負載胰島素的微針組以及同時負載礦化胰島素和礦化葡萄糖氧化酶的微針組的大鼠血糖均在1 h內下降到了6 mmol/L ~7 mmol/L。此外,負載胰島素的微針組在給藥6 h后大鼠的血糖水平恢復到了19.3 mmol/L;而同時負載礦化胰島素和礦化葡萄糖氧化酶的微針組在給藥10 h后大鼠血糖仍維持在較低的11.3 mmol/L,且在36 h內大鼠的血糖濃度均低于對照組(空白透明質酸微針組),說明相對于單純的胰島素給藥來說,同時負載礦化胰島素和礦化葡萄糖氧化酶的胰島素智能給藥系統降糖藥效更持久,藥物利用率更高。
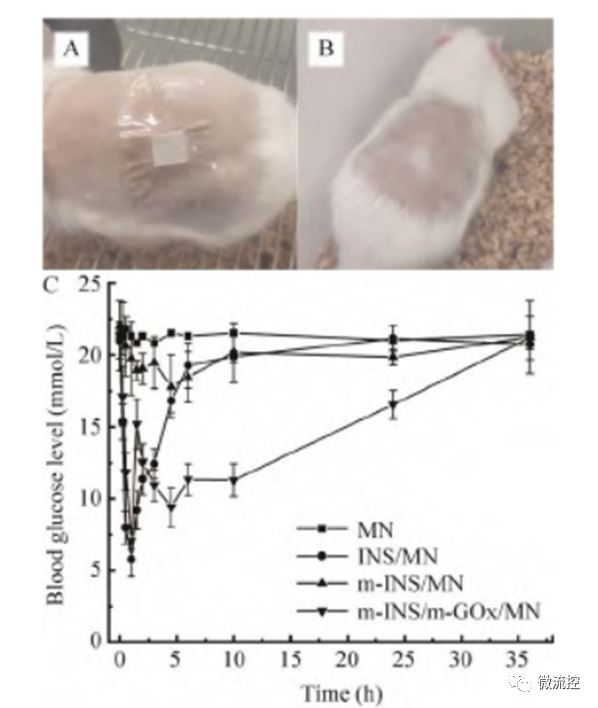
圖2 微針給藥動物實驗:(A)微針給藥時的糖尿病大鼠照片;(B)微針給藥36 h后的糖尿病大鼠照片;(C)負載不同藥物成分的微針降糖效果
同時負載礦化胰島素和礦化葡萄糖氧化酶的微針給藥后糖尿病大鼠的葡萄糖耐受性
將負載胰島素的微針以及同時負載礦化胰島素和礦化葡萄糖氧化酶的微針分別作用于3只糖尿病大鼠,1 h后待大鼠血糖接近正常范圍后,再腹腔注射1.5 g/kg的葡萄糖溶液,健康組的3只大鼠則直接注射葡萄糖溶液。由圖3A可以看出,注射葡萄糖后大鼠血糖均出現升高,其中健康組大鼠血糖在20 min達到14.0 mmol/L的峰值后快速下降,在150 min時恢復到了正常水平,而同時負載礦化胰島素和礦化葡萄糖氧化酶的微針組的大鼠血糖在40 min時達到16.3 mmol/L的峰值,然后緩慢下降并在150 min后維持在較低水平的11.1 mmol/L左右,而負載胰島素的微針組的大鼠血糖升高后則一直維持在較高的水平。此外,葡萄糖耐受實驗在0 ~ 150 min的血糖濃度曲線下面積積分結果表明,相對于負載胰島素的微針組,健康組和同時負載礦化胰島素和礦化葡萄糖氧化酶的微針組的葡萄糖耐受性明顯更強。
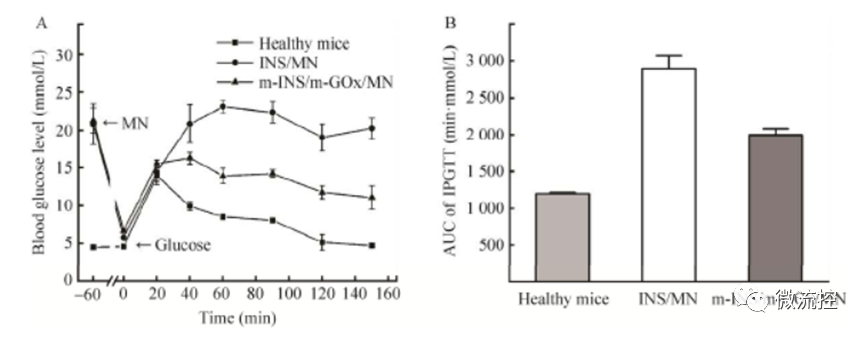
圖3 大鼠腹腔內葡萄糖耐受實驗:(A)血糖濃度變化曲線;(B)葡萄糖耐受實驗的曲線下面積
綜上所述,基于載藥可溶性透明質酸微針構建的具有血糖響應性的胰島素智能給藥系統具有良好的血糖濃度識別能力和胰島素響應釋放能力,能有效將胰島素遞送到大鼠皮下,從而安全、有效地降低糖尿病大鼠的血糖濃度,提高其葡萄糖耐受能力,不至于引發低血糖風險,具有替代胰島素注射給藥方式應用于糖尿病治療的潛力。
審核編輯:劉清
原文標題:基于透明質酸微針的胰島素智能給藥系統,用于糖尿病治療
文章出處:【微信號:Micro-Fluidics,微信公眾號:微流控】歡迎添加關注!文章轉載請注明出處。
發布評論請先 登錄
相關推薦
WT2605C藍牙語音芯片:引領糖尿病管理智能化,優化血糖儀音頻與藍牙傳輸方案

WT2605C藍牙語音芯片:引領糖尿病管理智能化,優化血糖儀音頻與藍牙傳輸方案
瑞薩用于連續血糖監測的閉環操作胰島素泵解決方案
美國FDA批準雅培公司兩款連續血糖監測系統
蘋果三星研發無創血糖監測技術,有望減輕依賴胰島素的糖尿病患者
研究人員設計制造一種基于生物阻抗譜的無電池植入式葡萄糖傳感器

磁熱響應的雙層微針貼片,用于慢性感染性創面的治療
基于墨水直寫3D打印技術的多功能微針貼片,用于個性化透皮給藥





 基于透明質酸微針的胰島素智能給藥系統,用于糖尿病治療
基于透明質酸微針的胰島素智能給藥系統,用于糖尿病治療










評論