細(xì)胞外囊泡(EVs)由不同類型細(xì)胞產(chǎn)生,對細(xì)胞間交流至關(guān)重要。不同細(xì)胞來源的EV亞群可以準(zhǔn)確地與各自對應(yīng)受體細(xì)胞精確相互作用,進(jìn)行內(nèi)化并發(fā)揮功能。因此,分離多個(gè)EVs亞群對于充分解析EVs生物功能具有重要意義。 目前已經(jīng)開發(fā)了多種EVs分離技術(shù),包括超速離心、尺寸排阻和親和分離等。其中,親和分離通常具有較好選擇性,其原理為主要通過抗體/核酸適體等識別分子對EVs上單一生物標(biāo)志物的相互作用以實(shí)現(xiàn)EVs分離。然而,盡管在某些應(yīng)用中親和分離行之有效,但由于大多數(shù)EVs亞群缺乏特異性單一生物標(biāo)志物,所以較難實(shí)現(xiàn)它們與密切相關(guān)的EVs混合群體的明確區(qū)分。
基于適體識別的DNA計(jì)算技術(shù)的快速發(fā)展為EVs分離分析離提供了一種強(qiáng)有力的工具。宋彥齡教授團(tuán)隊(duì)前期已發(fā)展了基于雙適體鄰位連接的特定EV亞群的高靈敏檢測方法(Angew. Chem. Int. Ed. 2021, 60, 7582),以及基于適體靶向識別和代謝標(biāo)記的EV特定蛋白糖基化成像方法(Angew. Chem. Int. Ed. 2021, 60, 18111)。然而,考慮到邏輯計(jì)算設(shè)計(jì)的復(fù)雜性以及EVs的高度異質(zhì)性,現(xiàn)有的方法往往一次只能定量一個(gè)特定的EVs亞群,難以同時(shí)分離多個(gè)EVs亞群。由于分離方法的缺乏,目前難以實(shí)現(xiàn)對多個(gè)EVs亞群同時(shí)分離分析及下游分析,從而阻礙了對EVs亞群生物學(xué)功能和臨床應(yīng)用的深入探索。因此,亟需發(fā)展一種多EVs亞群的分離策略。

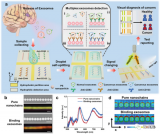
近日,廈門大學(xué)宋彥齡教授團(tuán)隊(duì)在國際期刊small methods上發(fā)表了題為“Isolation of PD-L1 Extracellular Vesicle Subpopulations Using DNA Computation Mediated Microfluidic Tandem Separation”的研究論文,開發(fā)了一個(gè)模塊化的串聯(lián)微流控分離平臺(tái)(如圖1所示),能夠?qū)⒍鄠€(gè)結(jié)合事件作為輸入,進(jìn)行邏輯計(jì)算,并產(chǎn)生兩個(gè)獨(dú)立的輸出,用于串聯(lián)微流控芯片的EVs亞群分離。該平臺(tái)利用雙適體識別的優(yōu)異選擇性和串聯(lián)芯片的靈活性,實(shí)現(xiàn)了腫瘤PD-L1 EVs和非腫瘤PD-L1 EVs的順序分離。因此,所開發(fā)的平臺(tái)不僅能有效區(qū)分癌癥患者和健康志愿者,還能為評估免疫異質(zhì)性提供新的線索。此外,捕獲的EVs可以通過DNA水解反應(yīng)高效釋放,與下游的質(zhì)譜分析兼容,進(jìn)行EV蛋白質(zhì)組分析。總的來說,這一策略有望分離出不同的EVs亞群,將EVs轉(zhuǎn)化為可靠的臨床生物標(biāo)志物,并準(zhǔn)確研究不同EVs亞群的生物學(xué)功能。文章通訊作者為廈門大學(xué)宋彥齡教授,第一作者為廈門大學(xué)碩士研究生盧銀珠與林冰倩博士。
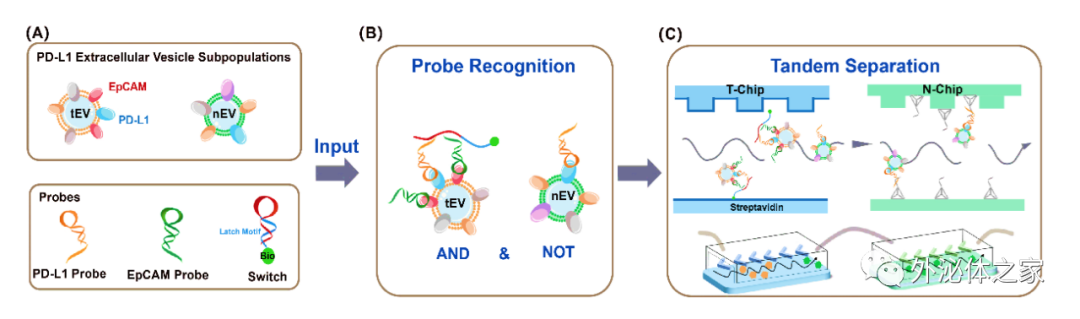
圖1 DNA計(jì)算介導(dǎo)的微流控串聯(lián)實(shí)現(xiàn)PD-L1細(xì)胞外囊泡亞群分離的原理
該論文將肺癌患者和健康志愿者的血漿樣本用來研究所開發(fā)策略的臨床效用。將血漿樣本與親和探針和開關(guān)探針孵育后通入到串聯(lián)芯片中。如圖2A所示,對于T-Chip,癌癥患者捕獲的EVs數(shù)量遠(yuǎn)遠(yuǎn)高于健康志愿者(t檢驗(yàn):P = 0.0006)。而對于N-Chip,除了一些健康志愿者的數(shù)值較高外,兩類樣品的區(qū)別并不明顯(圖2B,t檢驗(yàn):P = 0.02)。值得注意的是,對于N-Chip分離的PD-L1 EVs亞群,由于腫瘤患者中正常細(xì)胞產(chǎn)生的PD-L1 EVs可能因免疫逃逸而被分泌抑制,所以患者捕獲的EVs的平均量低于健康人。如果只是將同一樣本的兩種芯片信號簡單相加,而非順序分離,癌癥患者和健康志愿者的區(qū)別會(huì)被削弱(圖2C和2D,t檢驗(yàn):P = 0.04,ROC曲線的AUC值為:T-Chip為0.9664,T-Chip + N-Chip為0.7731),這可能是因?yàn)槊庖弋愘|(zhì)性導(dǎo)致正常細(xì)胞分泌的PD-L1 EVs數(shù)量差異較大造成。這些結(jié)果表明,該策略不僅可以通過腫瘤PD-L1 EVs區(qū)分癌癥和正常人,同時(shí)可以獲得正常細(xì)胞來源的PD-L1 EV亞群的數(shù)量,以協(xié)助免疫異質(zhì)性評估。
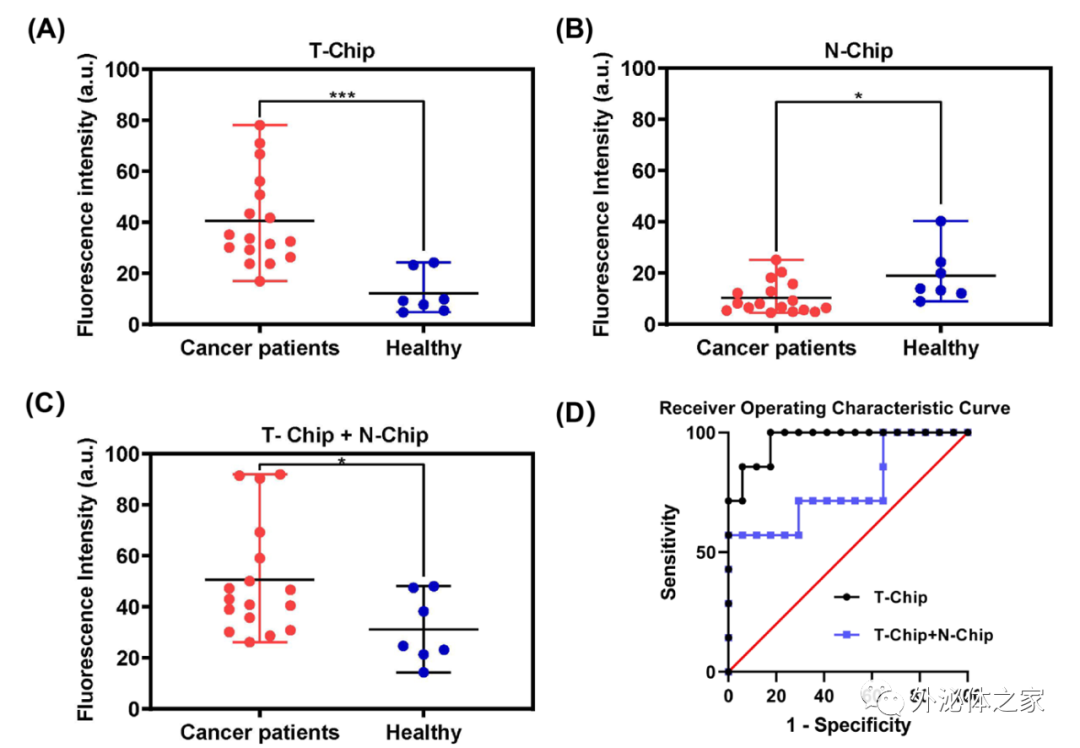
圖2 臨床樣本中腫瘤來源和非腫瘤細(xì)胞來源PD-L1 EVs定量
總體而言,所開發(fā)的平臺(tái)通過EVs亞群的同時(shí)分離,有望能讓人們更好地理解EVs的生物學(xué)功能、以及對癌癥進(jìn)展、免疫反應(yīng)以及對免疫治療耐藥性的實(shí)時(shí)評估。
論文鏈接:
https://doi.org/10.1002/smtd.202300516
-
DNA
+關(guān)注
關(guān)注
0文章
243瀏覽量
30983 -
微流控
+關(guān)注
關(guān)注
16文章
511瀏覽量
18863
原文標(biāo)題:利用DNA計(jì)算介導(dǎo)的串聯(lián)微流控平臺(tái),實(shí)現(xiàn)細(xì)胞外囊泡亞群的有效分離
文章出處:【微信號:Micro-Fluidics,微信公眾號:微流控】歡迎添加關(guān)注!文章轉(zhuǎn)載請注明出處。
發(fā)布評論請先 登錄
相關(guān)推薦
Aigtek高壓放大器在介電泳的微流控細(xì)胞分離技術(shù)中的應(yīng)用
S型微流控芯片的優(yōu)勢
ATG-2000系列功率信號源在介電電泳細(xì)胞分選測試中的應(yīng)用

ATA-7020高壓放大器在微流控3D細(xì)胞微球培養(yǎng)中的應(yīng)用
寬帶功率放大器基于微流控技術(shù)的細(xì)胞分選的應(yīng)用
玻璃微流控芯片前景分析
武漢大學(xué):研究微流控電化學(xué)集成傳感器,快速、高效分離和靈敏檢測致病菌
基于磁珠的液滴微流控平臺(tái),用于細(xì)胞外囊泡的高效分離
安泰ATA-7050高壓放大器在微流控細(xì)胞分選中的應(yīng)用
淺談微流控芯片技術(shù)

基于雙極性電極的微流控芯片,用于生物顆粒和細(xì)胞分選
基于離子濃度極化的微流控平臺(tái)用于ctDNA的高靈敏度檢測

如何利用磁性微流控系統(tǒng)實(shí)現(xiàn)免疫細(xì)胞分泌行為的定量檢測呢?
基于微流控技術(shù)和DNA納米材料制備的載細(xì)胞微凝膠研究




 利用DNA計(jì)算介導(dǎo)的串聯(lián)微流控平臺(tái),實(shí)現(xiàn)細(xì)胞外囊泡亞群的有效分離
利用DNA計(jì)算介導(dǎo)的串聯(lián)微流控平臺(tái),實(shí)現(xiàn)細(xì)胞外囊泡亞群的有效分離










評論