前言
癌癥目前仍然是全世界人類死亡的主要原因之一,約六分之一的死亡由癌癥所引起。據GLOBOCAN稱,每年癌癥病例數都在持續上升,預計到2040年將增至約3020萬例。
重現體內腫瘤生態位的困難
長期以來,重建微腫瘤生態位的現實模型一直是科學界面臨的巨大挑戰。內部異質性(即癌細胞、間質細胞、免疫細胞、血管細胞)、其他化合物(細胞因子與生長因子)和腫瘤的三維性影響了我們對腫瘤生態位的理解并阻礙了我們對其在體外進行相關復制。
目前,只有不到10%的已臨床試驗的抗癌藥物進入市場,而大多數抗癌藥物即便已經在臨床前試驗中取得了積極結果,但是還是在臨床開發的最后階段以失敗而告終。這些事實表明,目前的模型無法再現體內腫瘤生態位。
傳統的二維模型為研究腫瘤生物學提供了一個簡單而經濟的工具。然而,它們卻缺乏模擬體內復雜的細胞環境所需的必要特征 ,如細胞與細胞之間以及細胞與細胞外基質的相互作用(分化、增殖、形態、基因表達和其它功能),這些作用在二維模型中會發生改變 。
為了克服這些局限性,人們發明了更為復雜的方法,如具有類器官的三維模型(在表示活體組織空間的同時,也滿足了其化學復雜性的要求)。
盡管如此,目前仍有許多困難需要解決:一方面,類器官的形狀和大小是高度可變的,且被捕獲的細胞很難用顯微鏡技術進行量化和可視化。而另一方面的缺陷則是二維模型中缺乏人體組織細胞中常常接觸到的信號和流體 。
體內腫瘤生態位的模擬-微流控技術
微流控芯片上的器官模型能夠更好地模擬整個活體器官和實體腫瘤的微觀結構、動態力學性能和生化功能,并且能夠連續不斷地為其提供營養物質和藥物化合物 。此外,由于其尺寸小以及對藥劑的消耗較低,故其適合于高通量篩選。
目前使用的芯片器官設備涵蓋了癌癥領域的許多分支。除了模擬腫瘤微環境及其特征區域外,它也重現了腫瘤細胞的遷移和侵襲、轉移模型、血管化和外滲、腫瘤微環境再造、免疫腫瘤學研究、藥物篩選等。
了解癌細胞的遷移與轉移,將有助于我們對腫瘤治療策略產生新的認識,并根據腫瘤細胞遷移表型進行相關個性化診斷。該領域的最新發展讓研究人員不僅能夠生成一個更精細的模型來使得細胞在三維空間進行遷移,而且能夠對遷移表型進行單細胞排序與分析。
此外,腫瘤微環境的建模也是研究最頻繁的應用之一。在腫瘤微環境中,芯片模型有助于了解腫瘤相關巨噬細胞的激活以及它們增強腫瘤侵襲力的路徑 。而使用微流控技術的另一個巨大優勢則來自于為腫瘤和免疫細胞之間的相互作用提供了見解的腫瘤免疫研究 。
微流控技術在精確模擬腫瘤環境方面的重要性日益提高,并通過相關模型的成功研究縮小了先前體內與體外研究的差距,從而使個性化的醫學應用更接近實踐。
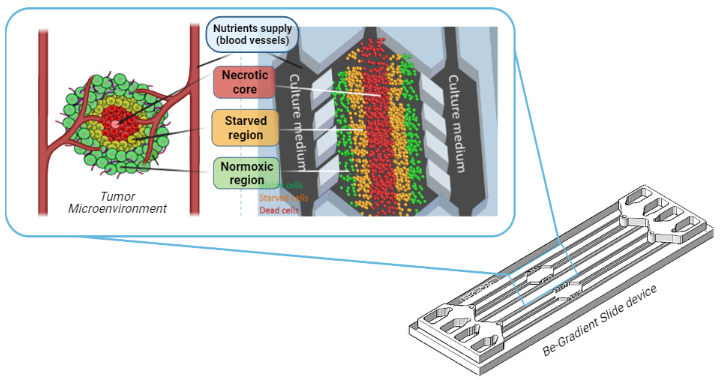
上圖顯示的是Beonchip公司制造的BE-Transflow裝置。它由一個中央腔室組成,腫瘤細胞在3D基質中培養形成一個腫瘤樣結構,中央壞死核心(紅細胞)被饑餓區域(橙色)和存活細胞外部區域(綠色細胞)包圍。中央腔室與兩個側面通道接觸,用于模擬血管,以向腫瘤細胞提供營養。(更多微流控產品信息請見https://dianchengbio.com/other-applications/microfluidic-chips/)
作者:Clara Byona and Sara Abizanda
參考文獻(部分):
1.Global Cancer Observatory. https://gco.iarc.fr/.
2. Duval, K.et al.Modeling Physiological Events in 2D vs. 3D Cell Culture.Physiology32, 266–277 (2017).
-
芯片
+關注
關注
453文章
50406瀏覽量
421817
發布評論請先 登錄
相關推薦
芯片上集成功能性血管化類器官的微流控平臺
使用原代腫瘤細胞進行藥物篩選的數字微流控系統
PDMS微流控芯片和PMMA微流控芯片的區別
微流控芯片3大制作技術
基于磁性探針的級聯相轉移微流控芯片用于循環腫瘤細胞檢測





 點成分享 | 如何重現體內腫瘤生態位?——微流控芯片來幫你
點成分享 | 如何重現體內腫瘤生態位?——微流控芯片來幫你











評論