一、前言
癌癥的不良預后與腫瘤細胞轉移的能力有關。
在轉移過程中,血液或淋巴管中循環的腫瘤細胞可以粘附并穿過內皮侵入結締組織。大多數與癌癥相關的死亡是由轉移形成引起的。從腫瘤細胞與原發性腫瘤分離開始,到侵入組織,進入血管或淋巴管(內滲),并運輸到遠程部位。
人們普遍認為,腫瘤細胞隨后可以從微血管系統中逃逸(外滲),侵入靶組織并在遠處器官中形成繼發性腫瘤。
因此,在轉移中一個潛在的限速步驟是外滲,該過程涉及腫瘤細胞與內皮細胞的粘附,以及通過內皮細胞單層和基底膜的遷移。黑色素瘤是最具侵襲性的皮膚癌之一,它會侵入皮膚的深層,并有早期轉移的傾向。
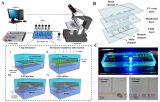
為了深入了解黑色素瘤細胞轉移的機制,本文介紹了一種利用Cellix VenaFlux平臺研究生理剪切流條件下黑色素瘤同基因模型中不同細胞粘附情況的應用實例。
二、實驗方法
1. 細胞收獲
黑色素瘤細胞系(1205-Lu、WM793、WM793-P1和WM793-P2)和綠色熒光蛋白標記的黑色素瘤細胞系GFP-1205Lu維持在含有GlutaMAX(Invitrogen)的DMEM中,輔以10%胎牛血清、100 U/ml青霉素、100 μg/ml 鏈霉素和 4 μg/ml 胰島素。人臍靜脈內皮細胞系 (HUVEC) 維持在含有1g/L葡萄糖 (Invitrogen)、補充有10%胎牛血清、5 ml/L慶大霉素和10 ml/L兩性霉素B溶液的DMEM中。
2. Vena8 Fluoro+ 生物芯片涂層
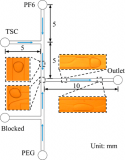
Vena8 Fluoro+生物芯片(400μm寬,100μm深)在涂上BSA (10 μg/ml)阻斷非特異性結合之前,在4°C的潮濕條件下用rhICAM-1(10 μg/ml)、rhVCAM-1(10 μg/ml) 或纖連蛋白(20 μg/ml)包被過夜。兩個額外的通道在室溫下用BSA涂敷兩小時。在剪切實驗之前,所有通道都用培養基洗滌三次。
3.VenaEC 生物芯片培養程序
將VenaEC生物芯片置于35 mm培養皿中(面積 9.61 cm^2)并在細胞接種前進行紫外線消毒20分鐘。將HUVEC細胞以75,000個細胞/cm^2 的密度接種在生物芯片上,并使其融合48小時。組裝的生物芯片(微通道600μm 寬,120μm深)在10 dyne/cm^2的剪切應力下預處理10分鐘,然后在0.5 dyne/cm^2 的剪切應力下預處理10分鐘。
4.附著力曲線和圖像捕獲
將黑色素瘤細胞系1205Lu、WM793、WM793-P1和WM793-P2(濃度5 x 10^6個細胞/ml)在 (A) 0.5 dyne/cm^2 的限定剪切應力下注入涂層通道,持續時間為 5 min(累積測定)或 (B) 5、2 和 0.5 dyne/cm^2 的遞減梯度剪切應力,持續時間為 2 min/剪切應力。使用Cellix的VenaFlux分析軟件捕獲圖像并使用Image Pro Premier軟件進行分析。從四個實驗中獲得數據并導出到Excel中以進行進一步分析。
使用VenaEC生物芯片檢查GFP-1205Lu細胞的粘附特性。GFP標記的細胞在匯合的HUVEC單層上受到0.5dyne/cm^2的剪切應力。在配備LD A-Plan 20x/0.30物鏡、0.5x相機適配器和DeltaPix DP200相機的Zeiss Axiovert 25 CFL顯微鏡上使用相差對單層進行成像。然后使用Zeiss濾光片組#9(激發BP450-490 nm,發射LP515)對熒光標記的黑色素瘤細胞進行成像。
三、結果與討論
在這項研究中,WM793、WM793-P1和WM793-P2細胞在0.5 dyne/cm^2的恒定剪切應力下沒有粘附到指定的粘附子上,而1205-Lu細胞在類似的剪切下粘附到V-CAM上(圖 1)。為了確定1205Lu細胞粘附到V-CAM的閾值剪切應力,施加了5、2和0.5 dyne/cm^2的遞減剪切應力,這導致1205-Lu細胞在剪切應力低于2dyne/cm^2時粘附增加(圖 2)。GFP-1205Lu細胞受到0.5 dyne/cm^2的剪切應力,并記錄到與內皮細胞的粘附(圖 3)。
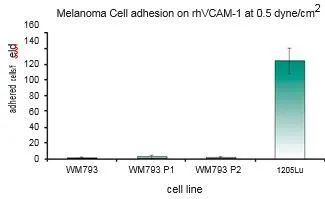
圖1:黑色素瘤細胞在0.5dyne/cm^2 的恒定剪切應力下粘附到rhVCAM-1
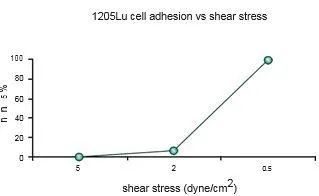
圖2:1205Lu細胞粘附到rhVCAM-1上的閾值
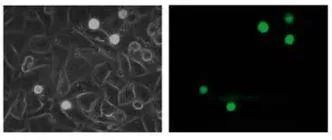
圖3:GFP-1205Lu粘附在內皮細胞上的代表性顯微鏡圖像
同基因模型系列由致瘤性差的黑色素瘤親代細胞系WM793及其衍生物WM793-P1、WM793-P2(來自小鼠在WM793注射部位發育的腫瘤)和1205-Lu(小鼠皮下注射WM793后發生自發性肺轉移,與親本系相比,在體外顯示出生長、侵襲和致瘤性增加)。
我們的研究結果表明,剪切應力在外滲過程中起重要作用。
1205-Lu細胞在較高剪切應力下附著于V-CAM的能力可能有助于其外滲能力,從而有助于其轉移。有趣的是,除了1205-Lu細胞外,所有細胞系在靜態條件下都具有高度粘附性,但在流動條件下卻無法粘附。
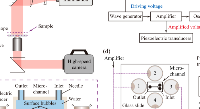
VenaFlux平臺
VenaFlux平臺是第一款半自動化的微流控平臺,能在模擬體內流速的剪切流下執行細胞滾動、結合/粘附和遷移研究,可滿足剪切流下進行細胞檢測的高通量需求。

-
芯片
+關注
關注
454文章
50430瀏覽量
421863 -
微流控
+關注
關注
16文章
512瀏覽量
18863
發布評論請先 登錄
相關推薦
常用的微流控芯片類型
ATA-1372A寬帶功率放大器在壓電驅動器機翼除冰中的應用
RIGOL產品在材料應力測試過程中的應用
三相微流控系統液滴在液-液界面上的自發轉移機制解析




 點成案例 | 利用微流控平臺探究剪切應力在黑色素瘤轉移中的潛在功能
點成案例 | 利用微流控平臺探究剪切應力在黑色素瘤轉移中的潛在功能
















評論