背景介紹
自2021年初以來,鋰價格上漲了7倍多,這對鋰離子電池(LIB)供應鏈提出了重大挑戰(zhàn)。預測顯示,到2030年可能出現(xiàn)嚴重的鋰供應短缺。在代替鋰離子電池的堿金屬電池中,鉀離子電池(KIB)比鈉離子電池(NIB)有明顯的優(yōu)勢,因為K+可以可逆地插入到石墨電極中。快速充電(~4C)對于電池來說也十分重要,特別是在電動汽車(EV)中,然而,傳統(tǒng)的LIB倍率性能有限。KIB在倍率和功率方面可能比LIB有優(yōu)勢。早期數(shù)據(jù)顯示,與LIBs相比,KIB的倍率性能有所提高,這表明KIB在非水系鉀離子電解質(zhì)中的傳輸速度更快。與Li+相比,K+尺寸更大,電荷密度更低,因此與溶劑分子的相互作用更弱,斯托克斯半徑更小,這有望促進離子在電解質(zhì)中的傳輸。雖然研究表明K離子電解質(zhì)的倍率性能有所提高,但要全面了解K離子電解質(zhì)的傳質(zhì),只能通過全面準確地描述基本的離子傳輸和熱力學性質(zhì):鹽擴散系數(shù)(D)、陽離子轉移數(shù)( )、離子電導率(κ)和熱力學因子(χM)來實現(xiàn)。然而,目前還沒有研究完全表征了K離子電解質(zhì)的離子傳輸和熱力學性質(zhì)。
)、離子電導率(κ)和熱力學因子(χM)來實現(xiàn)。然而,目前還沒有研究完全表征了K離子電解質(zhì)的離子傳輸和熱力學性質(zhì)。
正文部分 01 成果簡介
近日,牛津大學MauroPasta教授,研究了由雙氟磺酰亞胺鉀(KFSI)鹽和1,2-二甲氧基乙烷(DME)溶劑組成的非水系K離子電解質(zhì)溶液的離子傳輸和熱力學性質(zhì),并將其與濃度范圍0.25-2M的鋰離子電解質(zhì)(即LiFSI:DME)進行了比較。使用定制的K金屬電極,證明了KFSI:DME電解質(zhì)溶液比LiFSI:DME溶液具有更高的鹽擴散系數(shù)和陽離子轉移數(shù)。最后,通過Doyle-Fuller-Newman(DFN)模擬,研究了K∣石墨和Li∣石墨電池的K離子和Li離子存儲性能。
02 圖文導讀
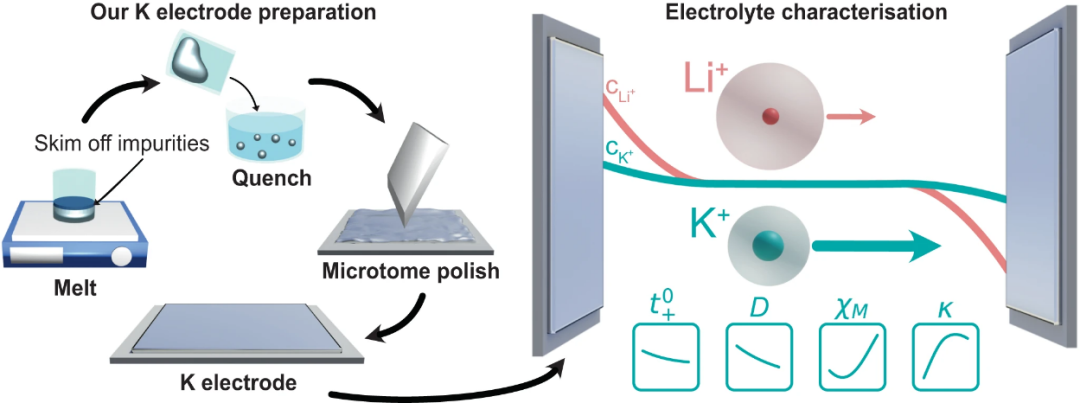
【圖1】K電極制備方案示意圖,以表征K離子電解質(zhì)鹽擴散系數(shù)(D),陽離子轉移數(shù)( ),離子電導率(κ)和熱力學因子(χM)。與LiFSI:DME相比,KFSI:DME的D和
),離子電導率(κ)和熱力學因子(χM)。與LiFSI:DME相比,KFSI:DME的D和 較高,導致濃度梯度較低。
較高,導致濃度梯度較低。
制備金屬鉀電極
本研究開發(fā)了一種K電極制備方法,以確保K金屬具有足夠的穩(wěn)定性。第一步是在一個充滿Ar的手套箱中熔化K金屬,撇去漂浮在熔體上的雜質(zhì),然后淬火。在電池組裝之前,將一個干凈的K金屬球體輥成金屬片(厚度約0.6mm),沖孔,并使用微切割技術對表面進行拋光(圖1)。
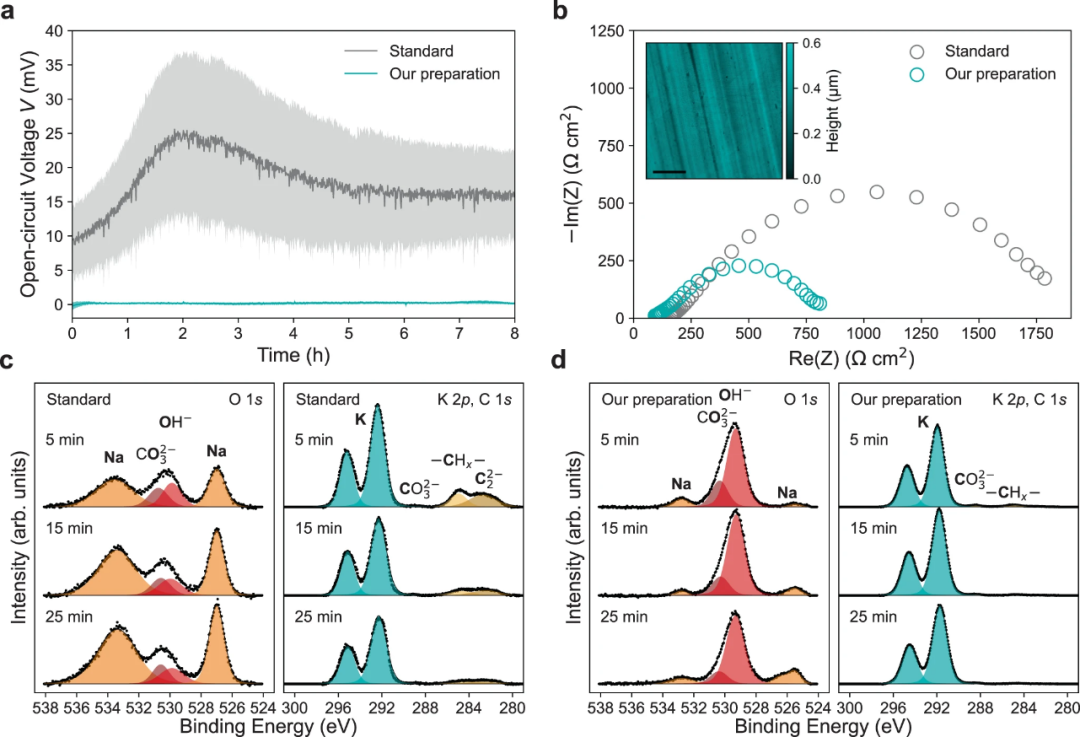
【圖2】本工作制備的K電極與標準K電極組裝的K∣∣K對稱電池在20°C下,1M KFSI:DME中的穩(wěn)定性。(a)靜置8小時的平均初始OCV曲線。(b)在20°C下休息1小時后的阻抗圖,插圖為AFM高度圖。Ar+濺射5,15和25min后K金屬的XPS深度分布圖(c)標準K電極的O1s, K 2p和C1s光譜和(d)本工作制備的K電極O1s, K 2p和C1s光譜。
圖2a顯示,與文獻中報道的標準制備過程相比,本工作制備的K電極對稱電池具有低的開路電壓(OCV),表明表面穩(wěn)定性和均勻性得到了改善。與標準方法相比,使用該制備方法制備的電池總阻抗大大降低(圖2b)。圖2b中插入的原子力顯微鏡(AFM)圖進一步表明該方法能夠實現(xiàn)表面均勻性,制備的K表面是平坦的,沒有污染。X射線光電子能譜(XPS)和Ar+深度分析顯示,用本工作中的方案制備的電極O1s光譜(圖2d)由529.3eV處的KOH峰主導。由于K金屬的高反應活性,這種KOH可能在XPS內(nèi)形成,因為新鮮的K金屬暴露,表明表面富含金屬K。
相反,圖2c中的氫氧化物峰強度相對較低,結合能為529.9eV,與NaOH一致。這表明在標準電極的表面只有有限的金屬K可以利用。圖2c中標準K電極的K2p XPS光譜顯示,隨著濺射深度的增加,K2p雙峰面積減小,而圖2d中本工作制備的K電極K2p雙峰在濺射過程中強度保持不變。在圖2c中,標準K電極表面還有一個C1s峰,表明有碳化物。因此,本工作的K電極制備工藝產(chǎn)生的富K電極表面具有更高的均勻性和更低的雜質(zhì)元素。
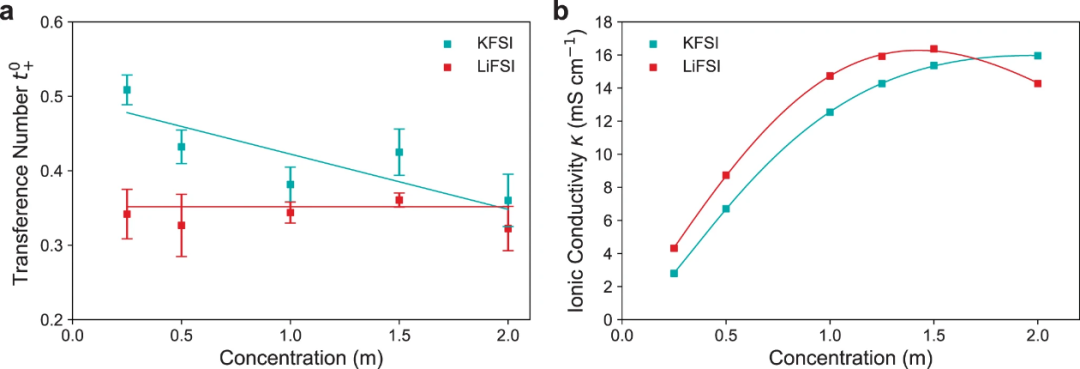
【圖3】20℃時,KFSI和LiFSI在二甲醚中的轉移數(shù)和離子電導率。(a)由希托夫實驗測得的陽離子轉移數(shù) 。(b)用電導池測量的離子電導率κ。
。(b)用電導池測量的離子電導率κ。
遷移數(shù)
陽離子轉移數(shù)為 ,是陽離子攜帶電流的分數(shù)。本工作采用希托夫法來表征遷移數(shù)。對一個大的對稱電池施加極化,然后關閉兩個旋塞形成三個隔離腔,提取溶液并測量其密度以確定濃度變化。通過公式(1)確定轉移數(shù)。K離子和Li離子電解質(zhì)鹽的偏摩爾體積
,是陽離子攜帶電流的分數(shù)。本工作采用希托夫法來表征遷移數(shù)。對一個大的對稱電池施加極化,然后關閉兩個旋塞形成三個隔離腔,提取溶液并測量其密度以確定濃度變化。通過公式(1)確定轉移數(shù)。K離子和Li離子電解質(zhì)鹽的偏摩爾體積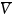 e用于確定
e用于確定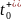 。
。

式中,Vchamber為陰極或陽極腔的體積,cf為實驗后腔的濃度,c為中性腔的濃度,Ipulse為施加的電流,tpulse為脈沖持續(xù)時間。圖3a顯示了DME中KFSI和LiFSI的有效遷移數(shù)。結果表明,在較低的濃度0.25M時,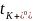 高于
高于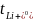 (分別為0.49和0.34),但隨著濃度的增加,
(分別為0.49和0.34),但隨著濃度的增加,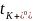 逐漸降低,在1.5~2M時僅略高于
逐漸降低,在1.5~2M時僅略高于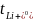 ,兩者呈現(xiàn)出逼近的趨勢,說明較低的K+電荷密度抑制了濃度增加時離子-離子和離子-溶劑的相互作用。隨著濃度的增加,
,兩者呈現(xiàn)出逼近的趨勢,說明較低的K+電荷密度抑制了濃度增加時離子-離子和離子-溶劑的相互作用。隨著濃度的增加,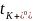 從0.49左右下降到0.38,表明離子-離子和離子-溶劑相互作用的增加對K+的結合作用比FSI?更強。而對于Li+,
從0.49左右下降到0.38,表明離子-離子和離子-溶劑相互作用的增加對K+的結合作用比FSI?更強。而對于Li+,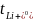 在整個濃度范圍內(nèi)保持恒定。
在整個濃度范圍內(nèi)保持恒定。
離子電導率
圖3b顯示,從低濃度到~1.5M, LiFSI具有較高的κ,此后κ顯著降低。然而,KFSI的κ隨濃度持續(xù)增加,并在2M處趨于平穩(wěn)。這表明,與~1.5M以上的KFSI電解質(zhì)相比,LiFSI電解質(zhì)可能存在顯著的物種間相互作用。1.5M以下的K離子電解質(zhì)電導率低于Li離子電解質(zhì)。由于KFSI的χM在較低濃度下比LiFSI更接近理想狀態(tài),表明離子-離子相互作用比Li+更少,因此在大多數(shù)濃度范圍內(nèi),KFSI的離子電導率較低可能是由于KFSI鹽解離度較低。
在高于1.7M的濃度下,LiFSI電導率的下降可能是由于Li+的離子-溶劑和離子-離子相互作用更大,因為其具有更高的電荷密度,Li+比K+能夠拖拽更多的溶劑,因此具有更強的溶劑化作用,而Li+更強的庫侖相互作用也導致更大的離子-離子結合,形成聚集體,增加了電解質(zhì)粘度。在KFSI:DME中,只有濃度超過一定范圍(>3M)才會形成聚集體。DME電解質(zhì)的離子電導率較高,KFSI:DME在2M處的電導率為16mS cm-1,LiFSI:DME在1.5M處的電導率為15mS cm-1。
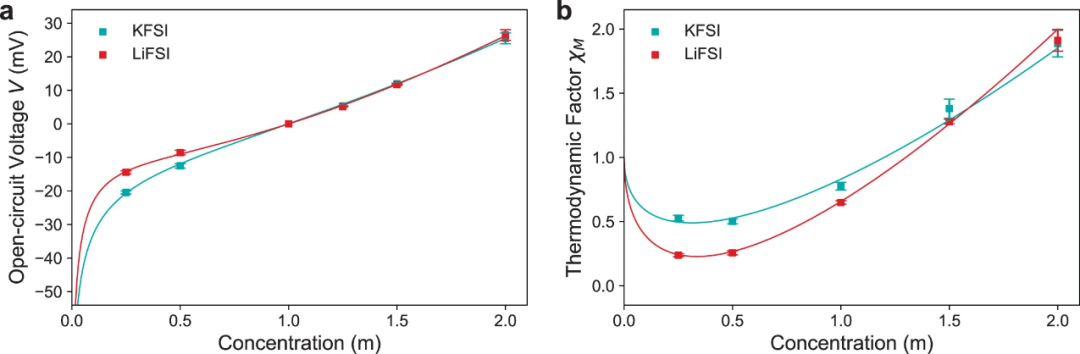
【圖4】20°C下,KFSI和LiFSIin DME的濃度池和熱力學因子數(shù)據(jù)。(a)濃度池開路電壓V。(b)熱力學因子χM。
熱力學因子
熱力學因子χM用于衡量電解質(zhì)的非理想性,并解釋了與能斯特行為的偏差,反映了鹽的熱力學活性如何隨濃度變化。使用濃度池測量χM,其中在“測試”溶液和“參考”溶液之間測量開路電壓。通過式(2),橫跨濃度池的OCV變化V隨摩爾濃度c的變化與熱力學因子χM和遷移數(shù)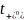 有關:
有關:
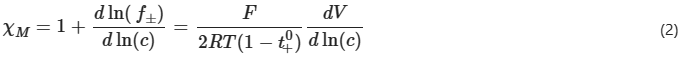
式中f±為平均摩爾活度系數(shù),F(xiàn)為法拉第常數(shù),R為氣體常數(shù),T為絕對溫度。溶劑濃度c0和溶劑的偏摩爾體積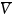 0可以用來計算熱力學因子。根據(jù)推導,將χM擬合到式(3)中給出的函數(shù):
0可以用來計算熱力學因子。根據(jù)推導,將χM擬合到式(3)中給出的函數(shù):

cm是摩爾濃度。A1和A2是擬合常數(shù)。OCV數(shù)據(jù)的擬合結果如圖4a所示。圖4b顯示了熱力學因子隨濃度的變化情況。隨著濃度的增加,第一庫侖離子-離子相互作用降低了鹽相對于DME的自由能,降低了鹽活度系數(shù),從而導致χM下降。隨著濃度的進一步增加,離子-溶劑相互作用增加,導致DME越來越多地結合,降低了溶劑蒸氣壓,從而增加了鹽活度系數(shù)和χM。結果表明,KFSI在較低濃度下的χM下降幅度明顯小于LiFSI。這可以歸因于以下兩個因素。首先,與Li+相比,K+尺寸更大,因此電荷密度更低,導致K+的庫侖離子-離子相互作用更弱,因此χM的減小較小。其次,從Debye-Hückel理論來看,在較低濃度下,DME中LiFSI和KFSI的χM下降梯度應該相等,因為它是由溶劑的介電常數(shù)ε決定的。由于Debye-Hückel理論假設電解質(zhì)完全解離,較低的KFSI梯度進一步表明鹽解離較差,因此在低濃度下其具有較低的離子電導率(圖3b)。在較高濃度下,LiFSI的χM隨濃度的增加也高于KFSI。這也是由于K+的電荷密度降低,導致與溶劑分子的相互作用減弱,因此與Li+相比,K+的溶劑化殼層更小。與Li+相比,較弱的K+溶劑化導致游離DME更多,因此KFSI的鹽活度系數(shù)和χM隨鹽濃度的增加而降低。
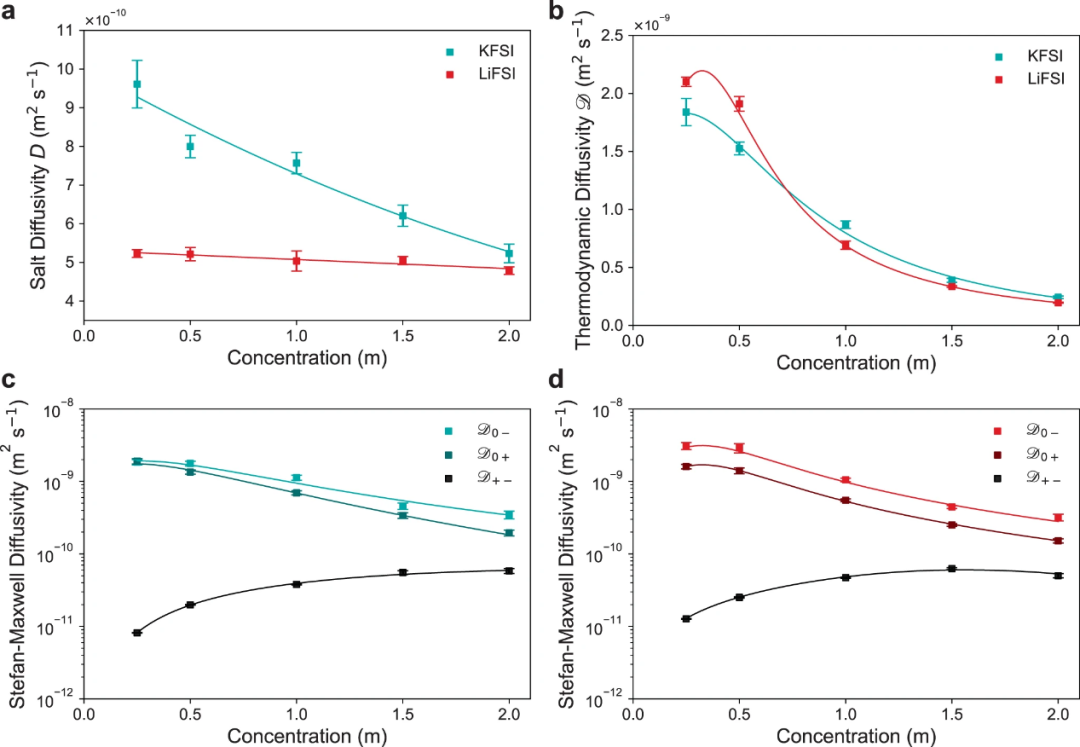
【圖5】用穩(wěn)態(tài)恒流限制擴散法測定KFSI和LiFSI在20℃二甲醚中的擴散系數(shù)。(a)鹽擴散系數(shù)D。(b)采用實測的熱力學因子計算熱力學擴散系數(shù)D。(c)KFSI和(d)LiFSI的Stefan-Maxwell擴散系數(shù)Dij。
擴散系數(shù)
穩(wěn)態(tài)極化和長期弛豫限制擴散被用來表征D,因為它比脈沖極化方法更準確,更不容易受到雙層弛豫效應的影響。本工作設計了一個受限擴散池,并使用恒流極化來形成濃度梯度。擴散系數(shù)D可以通過式(4)確定。

式中,V為弛豫時測得的受限擴散池OCV,Ls為體相電解質(zhì)厚度,t為時間,τdiff為特征衰減時間=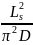 。
。
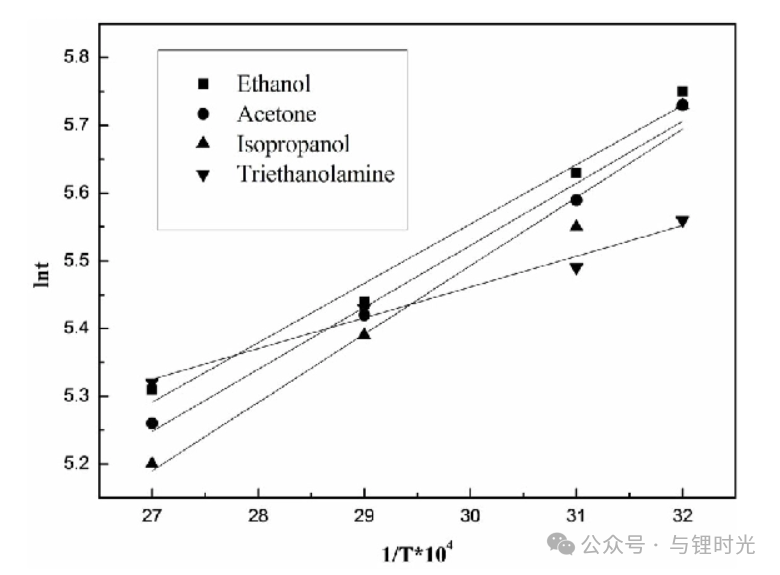
圖5a顯示,在20°C,所有濃度下KFSI的D都高于LiFSI。在1M處,DKFSI比DLiFSI高50%以上(分別為7.6× 10?10m2s?1和5.0× 10?10m2s?1)。這種差異在低濃度下最為顯著,DKFSI幾乎是DLiFSI的兩倍。隨著濃度的增加,DKFSI和DLiFSI之間的差異變得更小。DKFSI和DLiFSI都隨著濃度的增加趨向于相似的值,表明較低的電荷密度似乎延遲了濃度增加時離子-離子和離子-溶劑相互作用。
圖5b是用χM將D轉化為熱力學擴散系數(shù)D,反映了相對于鹽化學勢梯度的擴散系數(shù)而不是濃度梯度。D的初始增加是由于離子結合的增加導致,這是由于兩個物種有效地合并為一個物種,從而降低了對單個物種運動的阻力。如χM所示,由于Li+的離子-離子相互作用大于K+,DLiFSI顯示出更大的初始增加。在較高濃度下,DKFSI僅略高于DLiFSI,但表現(xiàn)出幾乎相同的趨勢,表明擴散行為差異與濃度梯度有關,而不是化學勢梯度。
Stefan-Maxwell擴散系數(shù)根據(jù)驅動擴散的熱力學力來描繪每種電解質(zhì)物種相對于彼此的遷移率,從而更深入地理解擴散行為。KFSI和LiFSI電解質(zhì)的Stefan-Maxwell系數(shù)分別如圖5c、d所示。KFSI和LiFSI的系數(shù)相似,這是由于它們具有相似的熱力學擴散系數(shù)。在整個濃度范圍內(nèi),LiFSI和KFSI的溶劑-離子擴散系數(shù)D0+和D0?都減小了約一個數(shù)量級,表明DME對陽離子和陰離子的阻力隨著鹽濃度的增加而增強。在LiFSI的濃度范圍內(nèi),D0?均高于D0+,表明與Li+與DME的相互作用相比,F(xiàn)SI?與DME的相互作用較弱。然而,對于KFSI,D0+和D0?更接近,在低濃度下幾乎相同。這是由于在0.25M處K+的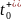 為~0.5。隨著濃度的增加,D0?和D0+之間的差異增大。LiFSI和KFSI的離子-離子擴散率D+?比溶劑-離子擴散率大約低兩個數(shù)量級,特別是在較低濃度下,表明兩者的離子相互作用都有些顯著。對于KFSI和LiFSI來說,D+?的最大值與它們的最大離子電導率相匹配,這表明在Li+濃度較低的情況下,由于缺乏游離DME,導致了更大的陽離子/陰離子相互作用。
為~0.5。隨著濃度的增加,D0?和D0+之間的差異增大。LiFSI和KFSI的離子-離子擴散率D+?比溶劑-離子擴散率大約低兩個數(shù)量級,特別是在較低濃度下,表明兩者的離子相互作用都有些顯著。對于KFSI和LiFSI來說,D+?的最大值與它們的最大離子電導率相匹配,這表明在Li+濃度較低的情況下,由于缺乏游離DME,導致了更大的陽離子/陰離子相互作用。
【圖6】使用KFSI和LiFSIinDME電解質(zhì)充電時,K∣石墨和Li∣石墨電池的DFN模擬。(a)模擬的金屬|(zhì)|石墨電池在2C恒流充電5分鐘后,Li+/K+電解質(zhì)濃度梯度。(b)2C充電時Li+/K+電解質(zhì)濃度梯度隨時間的變化。(c)隨著倍率的增加,金屬|(zhì)|石墨電池的濃差過電位。(d)隨著倍率的增加,金屬|(zhì)|石墨電池的容量。
模擬
為了了解電解質(zhì)傳輸和熱力學性質(zhì)差異對電池性能的影響,對采用KFSI和LiFSI:DME電解質(zhì)的K離子和Li離子石墨半電池充電行為進行了Doyle-Fuller-Newman(DFN)模擬。圖6a描繪了模擬的金屬∣∣石墨電池。在2C(1C=3.28mAcm-2)充電5分鐘后,KFSI電池與LiFSI電池相比,電解質(zhì)濃度梯度降低。由于存在過電位,在此之后不久,LiFSI電池達到了0.01V的截止電壓,低于此電壓將開始發(fā)生鋰金屬電鍍。圖6b顯示了在相同充電速率下隨時間變化的濃度梯度,結果再次顯示,KFSI電池的電解質(zhì)濃度梯度減小。圖6c顯示,濃度梯度的減少導致濃差過電位降低(在充電速率1–3C下,KFSI比LiFSI電池低~60%),再次證明了 和D的重要性。最后,圖6d顯示,KFSI電池可以在更高的充電速率下實現(xiàn)更高的容量。較高的鋰離子濃差過電位導致LiFSI電池達到更低的截止電壓,因此,鋰電鍍比KFSI電池更快,限制了容量。從圖6a,b中降低的K+電解質(zhì)濃度梯度來看,靠近集流體的石墨電極背面電解質(zhì)K+濃度明顯高于Li+濃度,表明石墨可插入的K+更多,從而獲得更大的容量。即使在4C的高充電速率下,KFSI電池也可以獲得19%的容量,而LiFSI電池只有1%。
和D的重要性。最后,圖6d顯示,KFSI電池可以在更高的充電速率下實現(xiàn)更高的容量。較高的鋰離子濃差過電位導致LiFSI電池達到更低的截止電壓,因此,鋰電鍍比KFSI電池更快,限制了容量。從圖6a,b中降低的K+電解質(zhì)濃度梯度來看,靠近集流體的石墨電極背面電解質(zhì)K+濃度明顯高于Li+濃度,表明石墨可插入的K+更多,從而獲得更大的容量。即使在4C的高充電速率下,KFSI電池也可以獲得19%的容量,而LiFSI電池只有1%。
總結和展望
本工作充分表征了K離子電解質(zhì)體系的離子傳輸和熱力學性質(zhì),并將它們與鋰離子體系進行了比較。此外,還開發(fā)了一種K金屬制備方法,使電解質(zhì)表征具有足夠的穩(wěn)定性。結果表明:在濃度低于2M時,KFSI:DME電解質(zhì)的鹽擴散系數(shù)和陽離子轉移數(shù)均顯著高于LiFSI電解質(zhì)。較高的鹽擴散系數(shù)和陽離子轉移數(shù)減少了離子濃度梯度的形成和濃差過電位,從而證實了KIB具有提高倍率性能和低溫性能的潛力。它們的離子電導率在20°C時相似,LiFSI略高,直到~1.7M,可能是由于KFSI鹽解離不足導致。熱力學因子隨濃度變化的行為表明,與Li+相比,K+的溶劑和離子相互作用較弱。本工作還對K離子和Li離子金屬|(zhì)|石墨電池進行DFN模擬,證明了KFSI:DME電解質(zhì)具有更快的傳輸特性,從而提高了充電速率。總的來說,本研究證明,增加陽離子尺寸和降低K+電荷密度,從而減弱溶劑-離子和離子-離子相互作用,有利于實現(xiàn)大功率電化學儲能系統(tǒng)。
審核編輯:劉清
-
鋰離子電池
+關注
關注
85文章
3215瀏覽量
77550 -
鋰電池
+關注
關注
259文章
8034瀏覽量
169526 -
電解質(zhì)
+關注
關注
6文章
805瀏覽量
20017 -
OCV
+關注
關注
0文章
25瀏覽量
12517 -
XPS
+關注
關注
0文章
97瀏覽量
11968
原文標題:牛津大學最新Nature子刊:鉀電與鋰電電解質(zhì)離子輸運及熱力學性質(zhì)差異的根源!
文章出處:【微信號:清新電源,微信公眾號:清新電源】歡迎添加關注!文章轉載請注明出處。
發(fā)布評論請先 登錄
相關推薦
無極電容器有電解質(zhì)嗎,無極電容器電解質(zhì)怎么測
聚合物電池和三元鋰電池的區(qū)別
具有密集交聯(lián)結構的明膠基水凝膠電解質(zhì)(ODGelMA)
如何判斷電解池的電勢高低?
電解質(zhì)電極信號采集控制板

請問聚合物電解質(zhì)是如何進行離子傳導的呢?
聚合物鋰電池是什么 鋰離子電池和聚合物鋰電池的區(qū)別
不同類型的電池的電解質(zhì)都是什么?
新型固體電解質(zhì)材料可提高電池安全性和能量容量
固態(tài)電解質(zhì)離子傳輸機理解析
鋰離子電池電解液有什么作用?
一種有機-無機非對稱固態(tài)電解質(zhì),實現(xiàn)長循環(huán)穩(wěn)定的高壓鋰電池





 鉀電與鋰電電解質(zhì)離子輸運及熱力學性質(zhì)差異的根源!
鉀電與鋰電電解質(zhì)離子輸運及熱力學性質(zhì)差異的根源!











評論