微流控系統已廣泛應用于各種體外組織工程模型中。近期,來自韓國成均館大學的GeunHyung Kim提出了一種新的微流控系統,用于制造在核心區域充滿各種形狀(珠子、念珠和細絲)的細胞細絲。相關研究內容以“Formation of various cell-aggregated structures in the core of hydrogel filament using a microfluidic device and its application as an in vitro neuromuscular junction model”為題發表在Chemical Engineering Journal期刊上。
這些結構是利用注射生物墨水的兩相流的瑞利-高原不穩定性(膠原蛋白/聚[乙二醇]二丙烯酸酯[PEGDA]的連續相和甲基丙烯酸化明膠(GelMA)的分散相)獲得的。為了證明該系統在體外神經肌肉連接模型上的潛力,將含有C2C12的膠原/PEGDA生物墨水注入鞘區域,并將與運動神經元細胞(NSC-34)混合的GelMA混合到制備的細胞聚集物的核心區域。由于更大的機械轉導,核心的念珠狀NSC-34聚集物比核心區域的珠子和細絲聚集物表現出更高的細胞活力和更發達的神經源性基因表達。此外,當比較充滿細胞的支柱(鞘區C2C12和念珠核心區NSC34)與具有相同細胞密度的正常生物打印支柱時,在充滿念珠狀細胞聚集物的支柱中,肌發生、神經肌肉連接(NMJ)和神經發生相關基因的表達顯著上調。這些實驗的結果證明了制造新的細胞負載核心鞘結構的潛力,可用于設計各種體外模型。
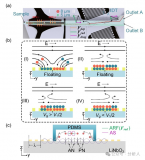
圖1A顯示了用于產生充滿纖維支柱的3D細胞聚集形狀的微流控裝置的示意圖。在該研究中使用了一個T型結微流控裝置,其中分散相被注入垂直于連續相。在T連接系統中將膠原蛋白/PEGDA連續流動,而沒有在分散流動中使用油和細胞裝載GelMA(圖1A、1B)。通過控制每個生物墨水的流變特性和流速以及原位光交聯,在核心區域獲得了三種不同的細胞聚集形狀(球體、念珠和纖維)(圖1C)。不同形狀的制造可以歸因于瑞利不穩定性,這種不穩定性會分散生物墨水的幾種不穩定流(噴射流、念珠流和滴流)的穩定共流(圖1D)。
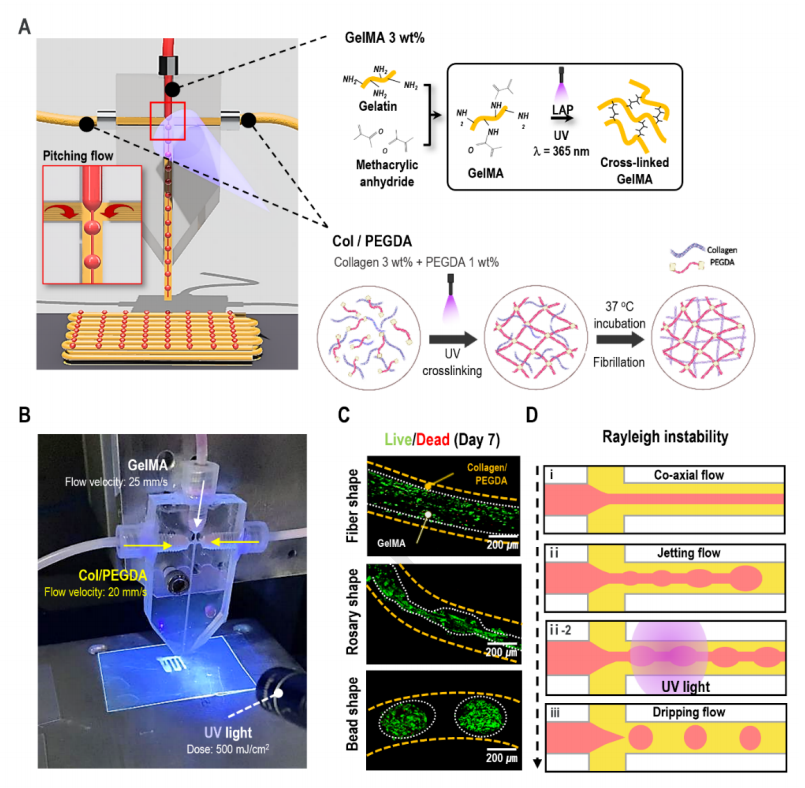
圖1 設計一種制造細胞聚合形狀的微流控系統
圖2A顯示了在蛋白質-PEGDA-水三元體系中,增加PEGDA作為結晶劑的濃度對蛋白質的影響的示意圖。圖2B顯示了不同PEGDA濃度下膠原蛋白/PEGDA生物墨水的儲存模量(G’)。增加生物墨水混合物中PEGDA的濃度可以提高G''的流變性能和屈服應力(σ),從而增強相鄰膠原之間的相互作用。根據混合生物油墨的透光率和印刷能力來評價這一現象(圖2C)。由于相分離,隨著PEGDA的加入,打印能力顯著降低。根據生物墨水的透光率和吸光度(圖2D、2E)以及打印支柱的直徑穩定性(圖2F)對結果進行了定量評價。混合物生物墨水表現出與原始膠原蛋白完全相似的纖維性顫動溫度,并且在10℃下進行光交聯過程后,膠原蛋白/PEGDA生物墨水的G'顯著增加(圖2G、2H)。
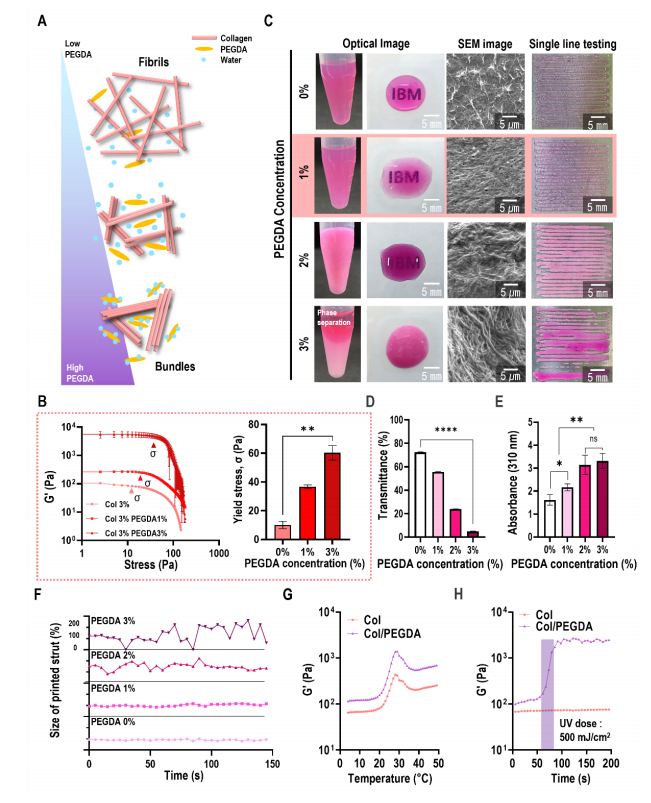
圖2 優化膠原蛋白/PEGDA生物墨水的配方
在該研究中,研究人員固定了連續相(膠原蛋白/PEGDA生物墨水)的粘度(13.8 Pa)和流速(20 mm/s),并改變了分散相(充滿細胞的GelMA生物墨水)的粘度和流速(圖3A)。GelMA隨著溫度的升高進行了凝膠-溶膠轉變(圖3B)。通過控制細胞裝載的GelMA加工溫度,在核心區域獲得了三種細胞聚集形狀(珠子、念珠和細線,圖3C)。通過改變GelMA在核心區域的流速,改變了GelMA區域制備結構(珠、念珠和纖維)的幾何形狀(圖3D ~ 3F)。圖3G顯示了在GelMA(15℃)溫度下的GelMA和Col/PEGDA輸入速度的過程圖,顯示了分散相的各種結構形成。
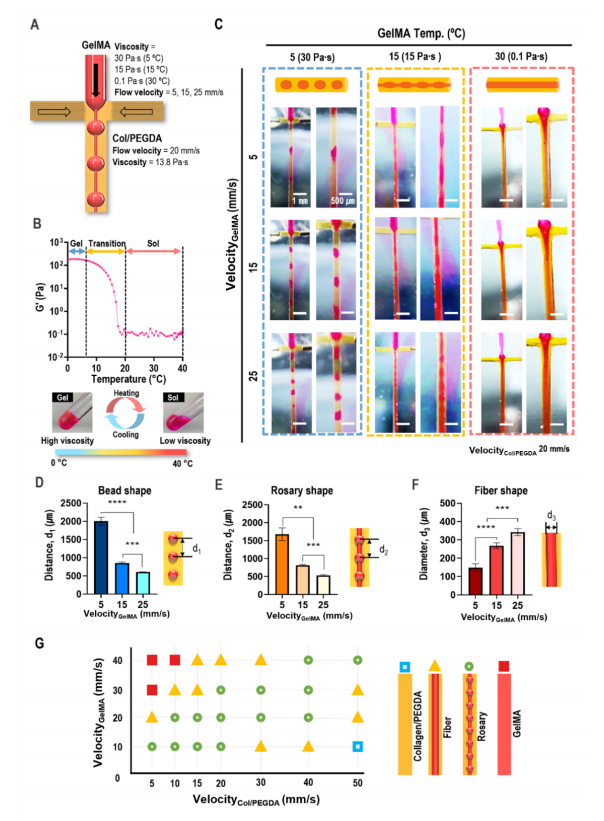
圖3 在核心區域制造多種細胞聚集形狀
為了觀察分散流體在T型結微通道中的行為,采用流體體積(VOF)法模擬了該過程,微通道詳細幾何形狀如圖4A所示。采用液滴懸浮法測量了表面張力,這是該工藝的重要材料參數之一,其值如圖4B所示。膠原蛋白在10℃時/PEGDA的粘度和GelMA在15℃和30℃時的粘度如圖4C所示。GelMA的粘度是制備分散相念珠形的關鍵因素,GelMA生物墨的輸入速度也是影響念珠結構的重要參數(圖4D)。圖4E顯示了GelMA分散相的輸入速度對念珠形狀的結構幾何形狀的影響(念珠之間的細線直徑r,波長λ,念珠直徑R)。圖4F顯示了通道內念珠和珠狀結構周圍的速度和壓力分布。結果表明,連續相對分散相施加的速度分布要快得多。圖4G為GelMA生物墨水在固定粘度(15 Pa)下的GelMA生物墨水的計算工藝圖和膠原/PEGDA生物墨水的固定材料參數,顯示了分散的相的各種結構形狀。實驗和模擬處理圖之間存在偏差,但GelMA處理溫度和連續分散流體速度對核心區域的制造形狀的影響也有類似的趨勢(圖4H)。 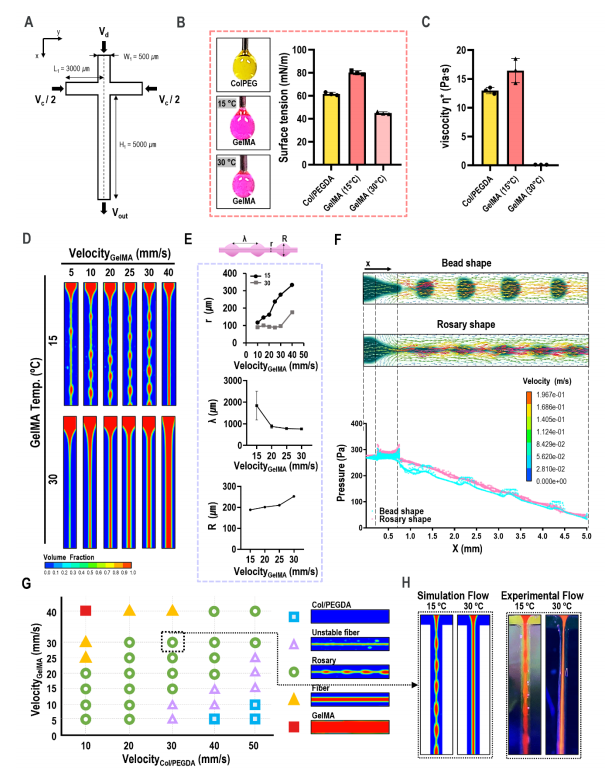
圖4 實驗結果和CFD模擬之間的比較分析,以評估核心區不同GelMA聚集形狀的形成
使用了由分散相和膠原/PEGDA水凝膠連續相組成的支柱評估細胞聚集形狀對生物活性的影響(圖5A)。分散相為三個不同的細胞聚集形狀,即珠子狀,念珠形狀[RS]和纖維形狀[FS],其中GelMA以細胞密度為2×10? cells/mL混合。圖5B、5C顯示了第3天和第7天的活(綠色)/死(紅色)細胞圖像和細胞活力,所有的支柱都顯示出足夠高的細胞活力,這表明微流控過程和原位交聯條件對負載的細胞是安全的。RS支柱中發生了細胞間和ECM之間的強大相互作用(圖5B、5D)。為了量化結構中的神經源性基因的表達,在第21天測量了第1天NEFH、NeuroG1、NeuroD1和突觸蛋白1的mRNA表達(圖5F)。
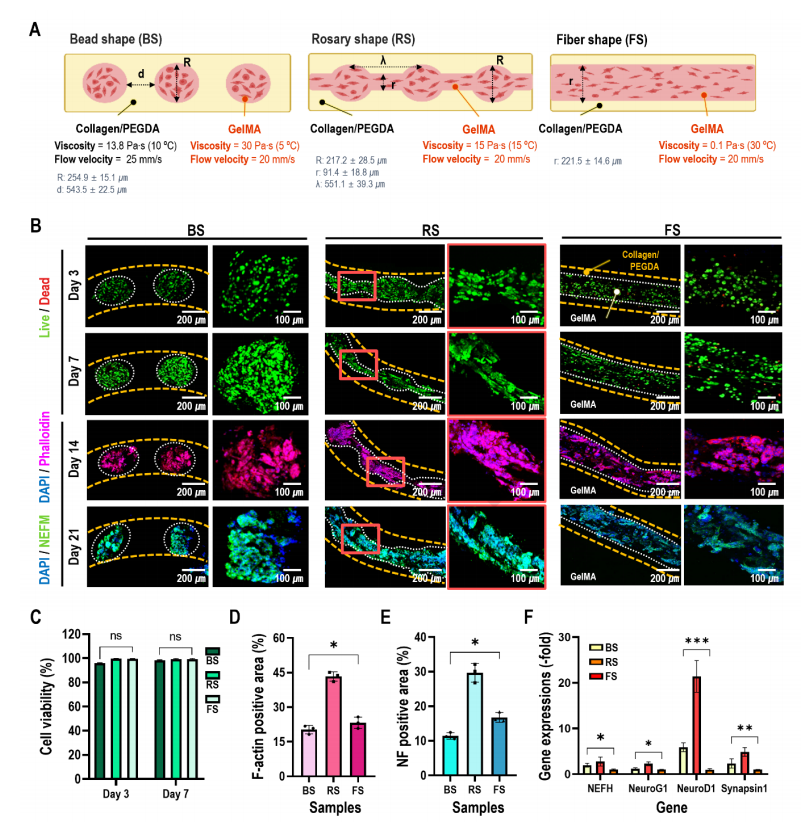
圖5 各種NSC-34在核心聚集形狀的體外細胞活性
如光學和免疫熒光圖像(DAPI/MHC/NEFM)和RT-PCR結果所示,共培養的NSC-34和C2C12細胞的比例為1:100,顯示肌原性、NMJ-和神經源性相關基因表達高度上調(圖6A、6B)。
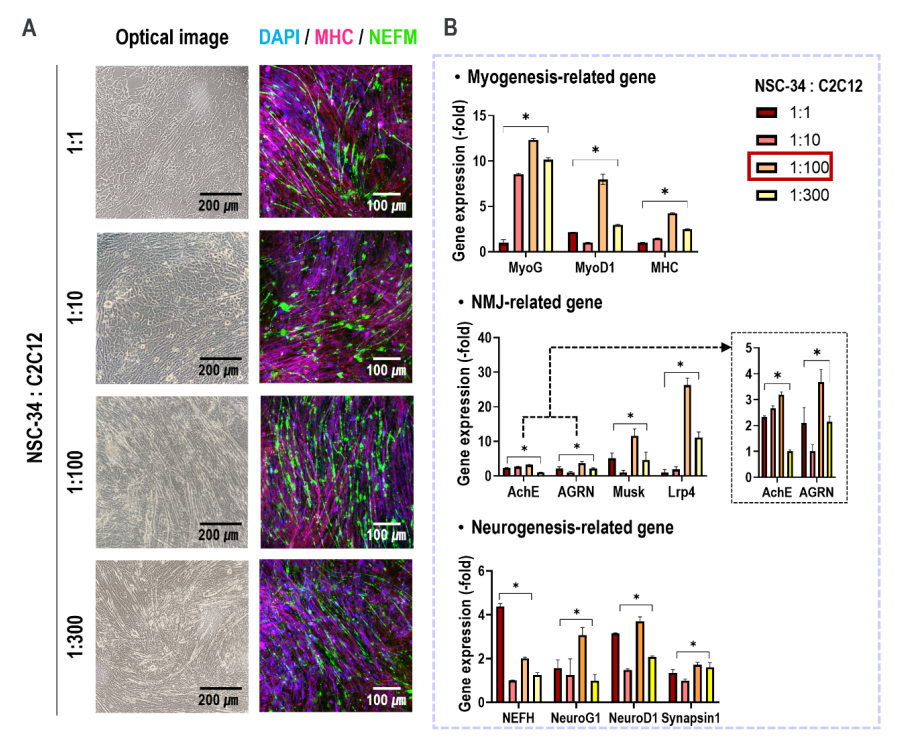
圖6 不同NSC-34和C2C12混合物比值的體外細胞活性
作為對照,使用用膠原蛋白/PEGDA/GelMA生物墨水包裹的NSC-34和C2C12細胞的混合物來制造細胞負載結構(圖7A)。圖7B顯示了通過MTT檢測的HRS結構和對照的細胞增殖,混合念珠結構(HRS)中細胞的增殖明顯高于對照組。圖7C顯示了用細胞追蹤器染色的每種細胞類型(綠色:C2C12;紅色:NSC-34)的熒光圖像,在圖像中對照組的細胞分布均勻,而在HRS結構中,含NSC的GelMA在C2C12細胞裝載的膠原/PEGDA水凝膠中呈念珠狀聚集。對照和HRS結構培養14和21天,觀察了神經絲的核心亞基之一dapi/MHC/NEFM(圖7D)。
在培養了這些結構之后,發現HRS結構比對照更能再生肌肉組織,由幾個肌肉特異性基因(MyoG、MyoD1、MHC)(圖7E)、NMJ特異性基因(AchE、Agrin、Musk和Lrp4)(圖7F)和神經發生基因(NeuroG1、NeuroD1、NEFH和突觸蛋白1)(圖7G)決定。一般來說,肌肉特異性基因如MHC、MyoG和MyoD1的表達表明再生組織成熟為功能性肌纖維。NMJ特異性基因的表達為再生組織的功能成熟提供了進一步的證據,因為這些基因參與了NMJ的形成和維持。 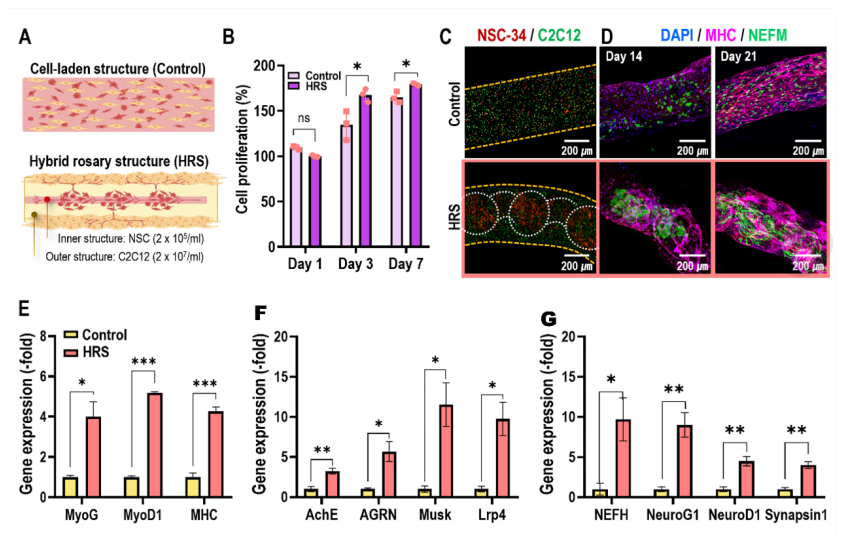
圖7 比較正常細胞負荷結構和雜交念珠結構之間的體外NMJ形成
該研究使用T型微流控裝置創建了一種填充不同形狀的微尺度細胞聚集物的新型混合支柱,以研究細胞聚集物形狀對細胞活動的影響。通過控制分散的相粘度和連續相速度,產生了球形、念珠狀和線狀的細胞聚集物。本研究結果顯示,膠原/PEGDA支柱中的念珠狀細胞聚集物在促進細胞活性方面最有效,包括增強神經源性活性,這是由于制造過程中細胞間的相互作用和制造過程中瑞利不穩定性產生的機械應力。為了證明該微流控裝置的可行性,在核心中創建了基于GelMA的NSC-34細胞聚集物和連續階段的C2C12細胞聚集物。
與傳統的生物打印支柱結構相比,裝載NSC-34的念珠結構表現出明顯更高的肌源性和神經源性分化以及NMJ的形成。本研究結果表明,這種利用混合細胞裝載結構的新的生物制造技術具有多種組織工程應用的潛力,包括生物芯片模型,并可能有助于增強組織再生。
審核編輯:劉清
-
微流控芯片
+關注
關注
13文章
249瀏覽量
18747 -
生物芯片
+關注
關注
3文章
77瀏覽量
16982 -
微流控系統
+關注
關注
1文章
60瀏覽量
1840
原文標題:利用微流控技術為體外神經肌肉連接模型“量身打造”各種細胞聚集結構
文章出處:【微信號:Micro-Fluidics,微信公眾號:微流控】歡迎添加關注!文章轉載請注明出處。
發布評論請先 登錄
相關推薦
微流控芯片3大制作技術
淺談微流控芯片技術





 利用微流控技術“量身打造”各種細胞聚集結構
利用微流控技術“量身打造”各種細胞聚集結構











評論