我們將LiFSI作為輔助鋰鹽,與LiPF6混合使用,充分發揮二者的優勢,研究了LiFSI的加入對電解液物化性能、導離子性能的影響,及其對電池倍率性能的影響。
電解質鋰鹽是鋰離子電池電解液的重要組成部分,目前市場上廣泛應用的是六氟磷酸鋰LiPF6-碳酸酯電解液。LiPF6具有溶解性好、離子傳導能力高、離子解離度高等優點,但是它熱穩定性差、易水解生成HF,而HF是造成電池性能衰減的重要原因。因此,近些年人們一直在努力尋求性能更優異的新型鋰鹽來替代傳統鋰鹽LiPF6。
雙亞胺鋰LiFSI是最近出現的比較熱門的新型鋰鹽,因其具有比LiPF6更好的熱穩定性、導離子能力及更高的鋰離子遷移數,成為最有希望取代LiPF6應用于高性能鋰離子電池中的鋰鹽。但是目前LiFSI的價格遠遠高于LiPF6,完全用它取代LiPF6作為主體鋰鹽用于電解液中的成本過高,商業化推廣較難。我們將LiFSI作為輔助鋰鹽,與LiPF6混合使用,充分發揮二者的優勢,研究了LiFSI的加入對電解液物化性能、導離子性能的影響,及其對電池倍率性能的影響。
1、實驗
1.1 電解液的配制及參數測定
將碳酸乙烯酯(EC)、碳酸二甲酯(DMC)、碳酸甲乙酯(EMC)和六氟磷酸鋰(LiPF6)在氬氣氣氛[棕(H2O)<1×10-6,棕(O2)<1×10-6]的手套箱中配制1.2mol/LLiPF6/(EC+EMC+DMC)(質量比1:1:1)電解液,以此電解液為基礎電解液,分別加入0.1/0.3/0.5mol/L氟代磺酰亞胺鋰(LiFSI)制得混合鹽電解液,用METTLERTOLEDODL32卡爾費休水分測定儀測試電解液的水含量,達到電池級使用標準[ω(H2O)≤1.5×10-5]的電解液才用于后續實驗。
在氬氣氣氛手套箱中,將裝有電解液的燒杯置于控溫(25±1)℃的油浴鍋中,用烏氏黏度計(=0.5~0.6mm)連續測試電解液的運動黏度3次,取平均值;用DDS-307型電導率儀測試電解液的電導率。
在氬氣氣氛的手套箱內,以金屬鋰為正、負極,Celgard2400膜為隔膜,添加自制電解液,組裝不同電解液的兩端Li不閉塞電池:Li|電解液|Li電池。參照恒電位極化法,用SL1287+1260型聯用電化學工作站測試電解液的Li+遷移數(+)。對電池施加10mV的電壓D,起始電流I0下降至穩定狀態的電流Iss,極化前、后電池電極電荷轉移阻抗與鈍化膜阻抗之和分別為Io、Iss。按式(1)計算t+。
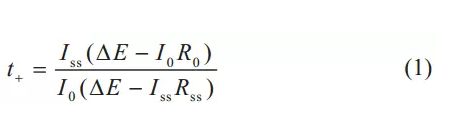
1.2 LiFePO4/Li半電池的組裝與性能測試
按質量比8:1:1將磷酸鐵鋰(LiFePO4)、導電劑超級碳黑SuperP和聚偏氟乙烯(PVDF)混合均勻,再加入N-甲基吡咯烷酮(NMP),攪拌成均勻的漿料,涂覆在20滋m厚的鋁箔(99.9%)集流體上,在120℃下真空(-0.1MPa,下同)干燥24h,再進行分切(=14mm),制成LiFePO4電極(含4.32mg活性物質)。
在氬氣氣氛手套箱中,以金屬鋰片為負極、LiFePO4電極為正極,組裝CR2025扣式電池,用CHI660C型電化學工作站進行循環伏安和交流阻抗測試。循環伏安測試的電位為2.5~4.0V,掃描速率為0.1mV/s;交流阻抗測試的頻率為105~10-2Hz,交流擾動電壓為5mV。
1.3 18650型電池的組裝與性能測試
按質量比91.0:1.0:2.0:1.5:4.5將LiFePO4、超級碳黑SuperP、導電石墨KS6、碳納米管(CNT)和PVDF混勻,然后加入NMP,攪拌成均勻的漿料,用轉移式涂布機涂覆在鋁箔集流體上,在120℃下真空干燥24h,再以8MPa的壓力壓成137滋m厚,分切成80cm×5.3cm的LiFePO4電極(含8.5g活性物質)。
按質量比93:2:5將天然石墨(AGP)、超級碳黑SuperP和PVDF混勻,然后加入NMP,攪拌成均勻的漿料,用轉移式涂布機涂覆在12滋m厚的銅箔(99.9%)集流體上,在120℃下真空干燥24h,再以11.5MPa的壓力壓成82滋m厚,分切成86cm×5.4cm的AGP電極(含5.0g活性物質)。
根據LiFePO4和AGP的比容量,設計正負極活性物質的質量配比及相應的電池工藝參數(負極容量約過量3%)。將制好的電極與Celgard2400膜卷繞成電芯,經裝殼焊接、滾槽、85℃真空干燥24h、注液(6g)及密封等工藝,制成18650型實驗電池。
用5V/10A自動充放電儀對電池進行化成,以0.5A恒流充電至3.65V,轉恒壓充電至0.1A,靜置10min后,以0.5A恒流放電至2.30V,循環3次。用恒流限壓、恒壓限流的充放電制度,在5V/20A自動充放電儀上進行倍率特性測試,電壓為3.65~2.00V。
2、結果與討論
2.1 電解液電導率、黏度及鋰離子遷移數
電導率是體現電解液離子傳導能力的一個重要物化參數,在一定程度上反應了電解質中電流的傳輸速度和電池內部阻抗。在一定的溫度下,電解液電導率與其黏度、鋰鹽濃度等因素直接相關。離子遷移數反應了某種離子運載的電流與通過溶液的總電流之比。在充放電過程中,鋰離子電池的電極反應所需要的電荷轉移主要由Li+承擔,而高的Li+遷移數能減輕電極反應的濃差極化,使電池產生高的比能量和比功率。一般來說,電導率和鋰離子遷移數直接反映了電解液的導離子能力。
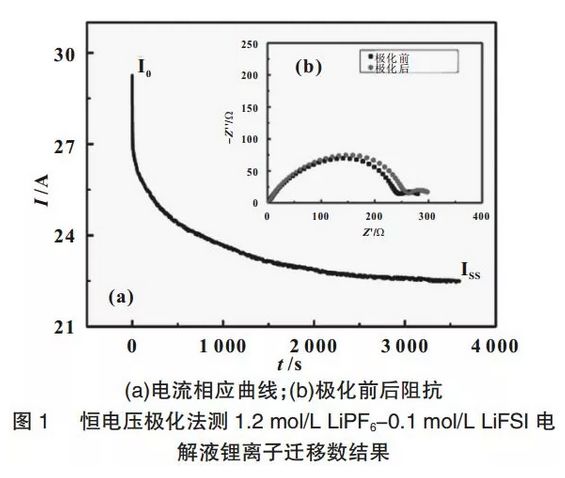
采用恒電位極化法測得鋰離子遷移數,圖1為1.2mol/LLiPF6-0.1mol/LLiFSI電解液鋰離子遷移數測試結果,由電流-時間曲線圖1(a)和極化前后電池阻抗譜圖圖1(b)組成。對電極體系加上10mV電勢差,初始時濃度梯度為零,流過電池兩端的電流為正負離子在電場力作用下的電遷移所決定,其初始電流為I0,隨后電流下降并達到穩態,穩態時負離子的運動對電流的貢獻為零,即體系的電流都是由正離子的運動所貢獻的,穩態電流為Iss。當電池極化前后,電極表面電荷轉移阻抗以及鈍化膜阻抗發生了變化,其值對應于阻抗譜的第一個半圓直徑。根據式(1)計算電解液的鋰離子遷移數。
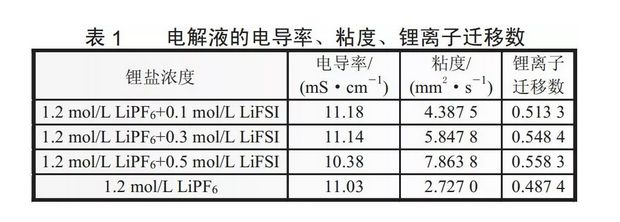
表1列出了加入不同量LiFSI后混合鋰鹽電解液的電導率、粘度及鋰離子遷移數。從表1中數據可知,當加入0.1mol/LLiFSI時,電導率由11.03增大到了11.18,同時鋰離子遷移數也由0.4874增大到0.5133;當LiFSI濃度增加到0.3mol/L時,因為粘度的增加使電導率有所下降,但仍高于未加LiFSI電解液的電導率,而此時鋰離子遷移數仍在增加;當LiFSI濃度進一步增大到0.5mol/L時,電導率繼續下降,低于未加LiFSI電解液,而此時鋰離子遷移數仍在增加。這說明加入適量的LiFSI能夠提高電解液的電導率和鋰離子遷移數,增大其導離子能力。
2.2 LiFePO4/Li半電池電化學阻抗與循環伏安測試
為了分析LiFSI的加入對電解液/LiFePO4界面的影響,以LiFePO4為工作電極、Li為對電極進行了循環伏安和交流阻抗測試。
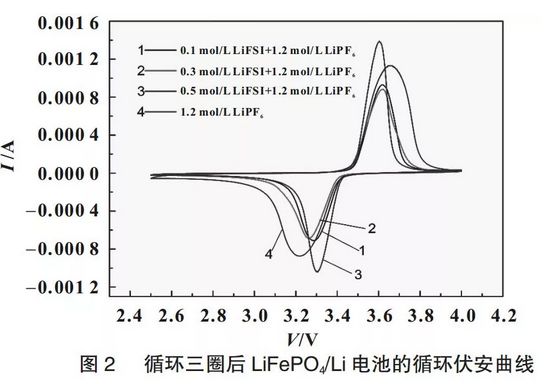
圖2為使用不同電解液的LiFePO4/Li半電池充放電3次后的循環伏安譜圖,由圖2可知,隨著LiFSI的加入,氧化峰和還原峰的峰位差在減小,說明LiFePO4的電極反應的可逆性在增加,這一方面是因為LiFSI的加入使電解液的鋰離子遷移數增大,能夠減小電池的濃差極化,提高電極反應的可逆性;另一方面也表明LiFSI的加入有助于在LiFePO4表面形成穩定的、導離子性好的鈍化膜,這一推測在電池的電化學阻抗譜中也得到了證實。
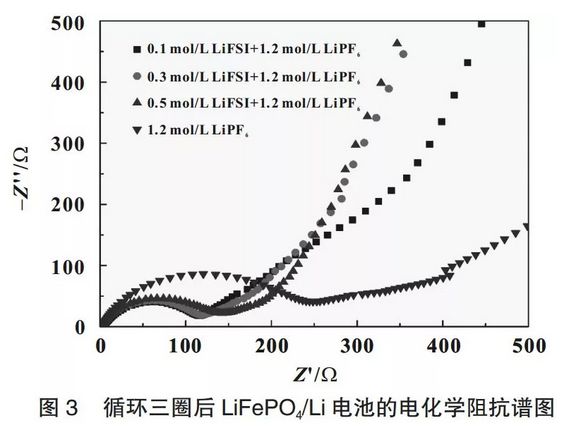
圖3為循環三圈后電池的電化學阻抗,電化學阻抗譜的Nyquist曲線由高、中頻區的半圓和低頻區的斜線組成,高、中頻區的半圓對應于工作電極表面鈍化膜阻抗以及電解液/電極界面電荷轉移阻抗之和,低頻區的斜線為Li+在電極中的擴散阻抗[7-8]。由圖3可知,相對于純LiPF6電解液,LiFSI的加入明顯降低了電解液/電極界面的阻抗,這說明LiFSI的加入使LiFePO4表面形成更有利于鋰離子通過的鈍化膜。
2.3 LiFePO4/石墨18650全電池倍率性能測試
為了考察混合鹽電解液在高功率電池中的應用,制備了LiFePO4/石墨18650全電池,對其進行0.5~20的倍率放電,測試結果如圖4所示。
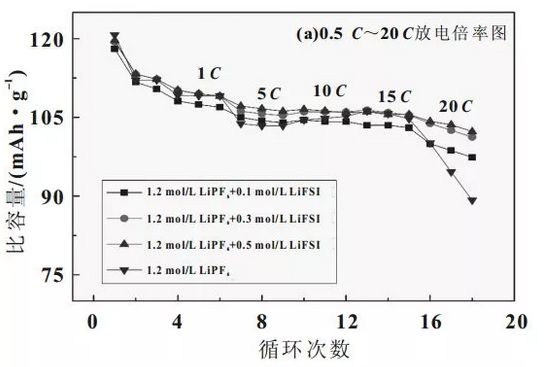
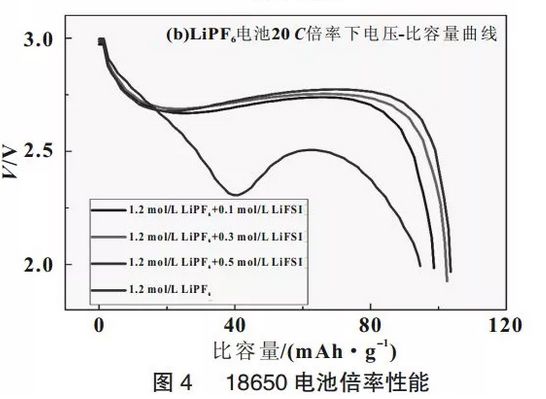
由圖4(a)可知,在倍率增大到15前,放電比容量大小存在微小的差異,隨著倍率繼續增大到20時,放電容量開始出現較明顯的不同,尤其是1.2mol/LLiPF6電解液的電池的放電性能衰減很快,由0.5的120.2mAh/g衰減到86.3mAh/g,容量保持率為71.8%;而加入0.5mol/LLiFSI的電解液電池則是從120mAh/g衰減到102.3mAh/g,容量保持率體高度了85.2%,圖4(b)為20放電時的電壓-容量曲線,從圖4中可見,LiFSI的加入大大改善了20放電性能,平均放電電壓由2.3V提高到2.75V,放電容量也有所提高。這主要源于LiFSI的加入,使得鋰離子遷移數增大,電解液中可遷移的Li+數目增多,濃差極化減弱,同時在電極表面形成阻抗較低的鈍化膜,這些因素使得LiFSILiPF6混合鹽電解液適合于高倍率放電。
3、結論
研究表明,LiFSI加入LiPF6電解液中能夠提高電解液的電導率和鋰離子遷移數,增強電解液導離子能力;同時LiFSI有助于降低電極表面膜阻抗,形成穩定的、導離子性較好的鈍化膜;18650全電池倍率測試結果表明LiFSI-LiPF6混合鹽更適用于高功率鋰電池。
-
鋰電池
+關注
關注
259文章
8034瀏覽量
169523 -
電解液
+關注
關注
10文章
839瀏覽量
23063
原文標題:【壯凌自動化?技術π】LiFSI-LiPF6混合鹽可改善鋰電池電解液性能
文章出處:【微信號:gh_a6b91417f850,微信公眾號:高工鋰電技術與應用】歡迎添加關注!文章轉載請注明出處。
發布評論請先 登錄
相關推薦
高壓電解電容虛標原因,高壓電解電容虛標怎么判斷
新宙邦擬在美國投建10萬噸/年電解液項目
LG、三星、索尼與A123圓柱電池設計及性能比拼




 加入LiFSI對電解液物化性能及對電池倍率性能造成哪些影響?
加入LiFSI對電解液物化性能及對電池倍率性能造成哪些影響?














評論