自2009年湯富酬研究員首次報道其開創性工作以來,單細胞RNA測序技術已經逐漸成為生物醫學研究的重要方法,其在發育生物學和干細胞領域展現出強大的應用前景。隨著單細胞轉錄組擴增方法的不斷優化,以及測序通量的持續提升,研究人員已經不再滿足于幾十甚至幾百個單細胞所提供的信息量。
2015年以來,一系列基于細胞條形碼標記的高通量單細胞RNA測序技術被相繼報道,其中尤以哈佛大學David Weitz實驗室開發的inDrop和Drop-seq,以及10X Genomics公司開發的Chromium系統最受關注。然而,如何從這些技術中選擇出最適合于自己項目的方法,成為每一個想從事單細胞轉錄組分析的科研人員首先面對的問題。
2018年11月21日,清華大學生命學院王建斌研究組和北京大學BIOPIC黃巖誼研究組以及上海交通大學附屬瑞金醫院劉峰研究員緊密合作,在Molecular Cell上發表了題為Comparative analysis of droplet-based ultra-high-throughput single-cell RNA-seq systems的研究論文,系統比較了inDrop、Drop-seq和Chromium三個系統在單細胞RNA測序方面的表現,并初步嘗試了基于inDrop系統的個性化開發,為未來研究中合理選擇檢測平臺提供了數據支持。
液滴超高通量單細胞RNA測序系統(droplet-based ultra-high-throughput single-cell RNA-seq systems)基于一個相同的原理,即利用微液滴將單個細胞與單個微球配對包裹,每個微球上帶有的獨特寡聚核苷酸序列可以對來自于不同單細胞的RNA進行區分標記,之后就可以對數千個單細胞的cDNA進行合并操作,每一條cDNA的細胞來源可以在后續的生物信息學分析中進行解讀。此方法使得實驗人員不必針對每一個單細胞進行繁瑣的重復操作,大大提高了實驗效率。
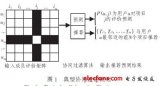
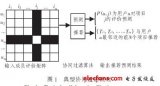
研究人員首先系統比較了三個系統的原理設計(下圖),尤其是微球及寡聚核苷酸序列的特性。通常情況下,細胞和微球需要分別經過高倍稀釋,從而避免同一液滴內存在多個細胞或者微球。由此導致的雙泊松分布大大降低了細胞的包裹效率。inDrop和Chromium系統所使用的大尺寸水凝膠微球可以被擠壓通過狹窄的微流通道,使得絕大部分液滴中有且僅有一個微球,細胞的利用率得到了顯著的提高。另一方面,inDrop系統所使用的CEL-seq單細胞轉錄組擴增技術耗時較長,整個實驗無法在當天完成。

為了有效比較三個系統的技術參數,研究人員選擇使用均質的淋巴母細胞作為實驗材料,并開發了一套同時兼容三個平臺數據的生物信息學分析流程。在數據分析過程中,研究人員首先發現微球表面的寡聚核苷酸序列并不完美,尤其是inDrop和Drop-seq系統所用微球,普遍存在內部序列不均一的問題。即使經過序列校正,inDrop和Drop-seq仍有約一半的測序數據無法被有效歸入具體的細胞,導致的測序數據的浪費和檢測靈敏度的下降。另一方面,UMI(unique molecular identifier)的加入可以有效提高inDrop和Drop-seq數據的均一性,而其對Chromium數據的改善非常有限。最終,在基因數和轉錄本數方面,三個系統所產生的數據均可以用于細胞亞型分析,其中Chromium系統展示出相對更高的靈敏度。
除了常規的技術參數分析以外,研究人員在對比三個系統所產生數據時還發現了顯著的系統特有差異,具體表現為數據按系統來源顯著分成了三個亞群,這提示大家未來在比較不同系統來源的數據時,要首先注意系統導致的表達差異。此外,針對inDrop系統特有的開發性,研究人員嘗試將單細胞轉錄組擴增方式由CEL-seq改為Smart-seq,并獲得了初步的成果,這展示出inDrop系統在特殊應用領域的潛在優勢。

近年來,針對整個器官乃至整個生物個體的超大規模單細胞研究項目逐漸成為國際會議中討論的焦點,其中尤以美國和歐洲科學家聯合開展的人類細胞圖譜(Human Cell Atlas)計劃最為著名。希望本文能夠對有意開展單細胞轉錄組研究的科研人員提供有效的指導。
據悉,清華大學生命學院王建斌研究員和北京大學BIOPIC黃巖誼教授為本文通訊作者,北京大學BIOPIC張先念博士、清華大學生命學院博士生李天奇、上海交通大學附屬瑞金醫院劉峰研究員、北京大學深圳研究生院博士生陳雅琪為本文共同第一作者。
-
RNA
+關注
關注
0文章
46瀏覽量
9701 -
數據分析
+關注
關注
2文章
1427瀏覽量
34015
原文標題:北京大學黃巖誼教授:比較液滴超高通量單細胞RNA測序
文章出處:【微信號:Microfluidics-Tech,微信公眾號:微流控科技】歡迎添加關注!文章轉載請注明出處。
發布評論請先 登錄
相關推薦
家長匯個性化測評系統的創新型招生策略(二)
HarmonyOS SDK,賦能開發者實現更具象、個性化開發訴求
基于Web挖掘的個性化網絡學習系統設計
Mascom已經選擇Bercut為其提供個性化彩鈴解決方案
知識個性化推薦系統研究

AI、大數據、腦科學個性化學習系統大講解
利用Pocket IO? PLC開發平臺展示未來工廠
大規模個性化定制研究綜述!





 基于inDrop系統的個性化開發,為未來研究中合理選擇檢測平臺提供了數據支持
基于inDrop系統的個性化開發,為未來研究中合理選擇檢測平臺提供了數據支持












評論