鋰離子電池電極過程動(dòng)力學(xué)探究中常用的有循環(huán)伏安法(CV)、電化學(xué)阻抗譜(EIS)、恒電流間歇滴定技術(shù)(GITT)、恒電位間歇滴定技術(shù)(PITT)、電流脈沖弛豫(CPR)、電位階躍計(jì)時(shí)電流(PSCA)和電位弛豫技術(shù)(PRT)等。
鋰電池的電極反應(yīng)主要包括哪些
電池中電極過程一般包括溶液相中離子的傳輸,電極中離子的傳輸,電極中電子的傳導(dǎo),電荷轉(zhuǎn)移,雙電層或空問電荷層充放電,溶劑、電解質(zhì)中陰陽(yáng)離子,氣相反應(yīng)物或產(chǎn)物的吸附脫附,新相成核長(zhǎng)大,與電化學(xué)反應(yīng)耦合的化學(xué)反應(yīng),體積變化,吸放熱等過程。這些過程有些同時(shí)進(jìn)行,有些先后發(fā)生。
電極過程的驅(qū)動(dòng)力包括電化學(xué)勢(shì)、化學(xué)勢(shì)、濃度梯度、電場(chǎng)梯度、溫度梯度。
分清兩電極和三電極
電化學(xué)測(cè)量一般采用兩電極電池或三電極電池,較少使用四電極電池。
兩電極
兩電極由研究電極(W),亦稱之為工作電極和輔助電極(C),亦稱之為對(duì)電極組成。鋰電池的研究中多數(shù)為兩電極電池,兩電極電池測(cè)量的電壓是正極電勢(shì)與負(fù)極電勢(shì)之差,無法單獨(dú)獲得其中正極或負(fù)極的電勢(shì)及其電極過程動(dòng)力學(xué)信息。
三電極
三電極電池包括,W和C分別是工作電極和對(duì)電極,R是參比電極。W和C之間通過極化電流,實(shí)現(xiàn)電極的極化。W和R之間通過極小的電流,用于測(cè)量工作電極的電勢(shì)。
通過三電極電池,可以專門研究工作電極的電極過程動(dòng)力學(xué)。
參比電極的特征
1、參比電極應(yīng)為可逆電極:
2、不易被極化,以保證電極電勢(shì) 比較標(biāo)準(zhǔn)和恒定:
3、具有較好的恢復(fù)特性,不發(fā)生 嚴(yán)重的滯后現(xiàn)象;
4、具有較好的穩(wěn)定性和重現(xiàn)性;
5、快速暫態(tài)測(cè)量時(shí),要求參比電極具有較低的電阻,以減少干擾,提高測(cè)量系統(tǒng)的穩(wěn)定性;
6、不同的溶液體系,采用相同的參比電極的,其測(cè)量結(jié)果可能存在差異,誤差主要來源于溶液體系間的相互污染和液接界電勢(shì)的差異。
常用的參比電極
水溶液體系參比電極:可逆氫電極、甘汞電極、汞一氧化汞電極、汞一硫酸亞汞電極等;
非水溶液體系參比電極:銀一氯化銀電極、Pt 電極以及金屬鋰、鈉等電極。
其他:也可以用銀絲、鉑絲做準(zhǔn)參比電極,或者采用電化學(xué)反應(yīng)電位穩(wěn)定的溶解于電解液的二茂鐵氧化還原電對(duì)。
關(guān)于準(zhǔn)參比電極細(xì)節(jié)可參考A.J.Bard編著的(Electrochemical Methods)。
電極過程
電極過程一般情況下包括下列基本過程或步驟:
1、電化學(xué)反應(yīng)過程:在電極/溶液界面上得到或 失去電子生成反應(yīng)產(chǎn)物的過程,即電荷轉(zhuǎn)移過程;
2、傳質(zhì)過程:反應(yīng)物向電極表面或內(nèi)部傳遞或反應(yīng)產(chǎn)物自電極內(nèi)部或表面向溶液中或向電極內(nèi)部的傳遞過程(擴(kuò)散和遷移);
3、電極界面處靠近電解液一 側(cè)的雙電層以及靠近電極內(nèi)一側(cè)的空間電荷層的充放電過程;
4、溶液中離子的電遷移或電子導(dǎo)體、電 極內(nèi)電子的導(dǎo)電過程。
此外,伴隨電化學(xué)反應(yīng),還有溶劑、陰陽(yáng)離子、電化學(xué)反應(yīng)產(chǎn)物的吸附/脫附過程,新相生長(zhǎng)過程以及其它化學(xué)反應(yīng)等。
典型的電極過程及動(dòng)力學(xué)參數(shù)
離子在電解質(zhì)中的遷移電阻(Rsol);離子在電極表面的吸附電阻和電容(Rad,Cad);電化學(xué)雙電層電容(Cdl);空間電荷層電容(Csc);離子在電極電解質(zhì)界面的傳輸電阻(Rincorporation);離子在表面膜中的輸運(yùn)電阻和電容(Rfilm,Cfilm);電荷轉(zhuǎn)移(Rct);電解質(zhì)中離子的擴(kuò)散電阻 (Zdiffusion);電極中離子的擴(kuò)散(Zdiffusion)——體相擴(kuò)散(Rb)和晶粒晶界中的擴(kuò)散(Rgb);宿主晶格中外來原子/離子的存儲(chǔ)電容(Cchem);相轉(zhuǎn) 變反應(yīng)電容(Cchem);電子的輸運(yùn)(Re)。
值得注意的是,不同電極過程的響應(yīng)時(shí)間不同,總的來說:電荷轉(zhuǎn)移<表面反應(yīng)<電子傳輸<界面擴(kuò)散<固相反應(yīng)<體相擴(kuò)散,因此離子在電極、電解質(zhì)材料內(nèi)部的擴(kuò)散以及固相反應(yīng)一般是速率控制步驟。
極化及類型
在施加了外來電場(chǎng)后,電池或電極逐漸偏離平衡電勢(shì)的狀態(tài),稱之為極化。極化電勢(shì)與平衡電勢(shì)的差值的大小被稱之為過電勢(shì)。
在不具有流動(dòng)相的電池中,存在著3種類型的極化:
1、化學(xué)極化—— 與電荷轉(zhuǎn)移過程有關(guān)的極化,極化的驅(qū)動(dòng)力是電場(chǎng)梯度。電化學(xué)極化的大小是由電化學(xué)反應(yīng)速率決定的,電化學(xué)極化電阻(Rct)的大小與交換電流密度直接相關(guān)。
2、濃差極化——與參與電化學(xué)反應(yīng)的反應(yīng)物和產(chǎn)物的擴(kuò)散過程有關(guān)的極化,極化的驅(qū)動(dòng)力為濃度梯度。濃差極化與傳質(zhì)粒子的擴(kuò)散系數(shù)有關(guān)。
3、歐姆極化——與載流子在電池中各相輸運(yùn)有關(guān)的極化,驅(qū)動(dòng)力是電場(chǎng)梯度。歐姆極化的大小是由電池內(nèi)部涉及到電遷 移的各類電阻之和,即歐姆電阻決定的。
若還存在其它基本電極過程,如勻相或多相化 學(xué)反應(yīng)過程,則可能存在化學(xué)反應(yīng)極化。
電化學(xué)測(cè)量方法在鋰電池中的經(jīng)典應(yīng)用
鋰離子電池電極材料在電池充放電過程中一般經(jīng)歷以下幾個(gè)步驟:
1、劑化的鋰離子從電解液內(nèi) 遷移到電解液/固體電極的兩相界面;
2、溶劑化的鋰 離子吸附在電解液/固體電極的兩相界面;
3、去溶劑化;
4、電荷轉(zhuǎn)移,電子注入電極材料的導(dǎo)帶,吸附態(tài)的鋰離子從電解液相遷移至活性材料表面晶格;
5、鋰離子從活性材料表面晶格向內(nèi)部擴(kuò)散或遷移;
6、電子從集流體向活性材料的遷移。
循環(huán)伏安法
常用于電極 反應(yīng)的可逆性、電極反應(yīng)機(jī)理(如中間體、相界吸 /脫附、新相生成、偶聯(lián)化學(xué)反應(yīng)的性質(zhì)等)及電極反應(yīng)動(dòng)力學(xué)參數(shù)(如擴(kuò)散系數(shù)、電極反應(yīng)速率常數(shù)等)的探究。
電勢(shì)向陰極方向掃描時(shí),電活性物質(zhì)在電極上還原,產(chǎn)生還原峰;向陽(yáng)極方向掃描,還原產(chǎn)物重新在電極上氧化,產(chǎn)生氧化峰。因而一次掃描,完成一個(gè)還原和氧化過程的循環(huán),其電流一電壓曲線稱為循環(huán)伏安曲線。
通過循環(huán)伏安曲線的氧化峰和還原峰的峰高、對(duì)稱性、氧化峰與還原峰的距離,中點(diǎn)位置,可判斷電活性物質(zhì)在電極表面反應(yīng)的可逆程度和極化程度。如果氧化與還原反應(yīng)的過電位 差別不大的化,還可以把一對(duì)氧化峰與還原峰之間的中點(diǎn)值近似作為該反應(yīng)的熱力學(xué)平衡電位值。
另外恒電流充放電的電壓容量曲線微分后以dQ/dV 作為縱軸,橫軸為電壓,可以獲得與CV曲線十分相似的結(jié)果,其實(shí)本質(zhì)并沒區(qū)別。
循環(huán)伏安法計(jì)算鋰離子擴(kuò)散系數(shù)
注意:僅適用于擴(kuò)散過程為控制步驟且電極為可逆體系,此時(shí)有公式
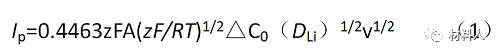
常溫時(shí),

式中,Ip為峰電流的大小,n為參與反應(yīng)的電子數(shù),A為浸入溶液中的電極面積,F(xiàn)為法拉第常數(shù),DLi為L(zhǎng)i在電極中的擴(kuò)散系數(shù),v為掃描速率,△C0為反應(yīng)前后待測(cè)濃度的變化。
可以按如下步驟來計(jì)算:
1、測(cè)量電極材料在不同掃描速率下的循環(huán)伏安曲線;
2、將不同掃描速率下的峰值電流對(duì)掃描速率的平方根作圖;
3、對(duì)峰值電流進(jìn)行積分,測(cè)量樣品中鋰的濃度變化;
4、將相關(guān)參數(shù)帶入式(2),即可求得擴(kuò)散系數(shù)。
需要注意的是,由于以下幾個(gè)原因,其測(cè)得的絕對(duì)值在不同文獻(xiàn)中不盡相同
需要該反應(yīng)收擴(kuò)散控制,而且循環(huán)伏安測(cè)到的化學(xué)擴(kuò)散系數(shù)并非電極材料內(nèi)部本征的離子擴(kuò)散系數(shù)(詳細(xì)內(nèi)容請(qǐng)見擴(kuò)展閱讀)。還有就是,如果是多孔粉末電極,其真實(shí)反應(yīng)面積遠(yuǎn)大于電極幾何面積,且難以精確測(cè)量,給結(jié)果帶來很大的不確定性。
當(dāng)然,關(guān)于循環(huán)伏安法原理使用等,我們會(huì)另外詳細(xì)介紹。
交流阻抗譜
我們將交流阻抗譜的內(nèi)容已經(jīng)介紹過,詳情見此2篇文章:
【干貨】79頁(yè)P(yáng)PT——鋰電之電化學(xué)阻抗譜(EIS)詳解
【干貨】鋰電之電化學(xué)阻抗譜(EIS)簡(jiǎn)析
恒電流間歇滴定技術(shù)
恒電流問歇滴定技術(shù)(galvanostatic intermittent titration technique)由德國(guó)科學(xué)家W.Weppner提出, 基本原理是在某一特定環(huán)境下對(duì)測(cè)量體系施加一恒 定電流并持續(xù)一段時(shí)問后切斷該電流,觀察施加電流段體系電位隨時(shí)間的變化以及弛豫后達(dá)到平衡的電壓,通過分析電位隨時(shí)閭的變化可以得出電極過 程過電位的弛豫信息,進(jìn)而推測(cè)和計(jì)算反應(yīng)動(dòng)力學(xué)信息。
當(dāng)體系滿足如下條件時(shí),可以計(jì)算鋰離子擴(kuò)散系數(shù)
1、電極體系為等溫絕熱體系;
2、電極體系在施加電流時(shí)無體積變化與相變;
3、電極響應(yīng)完全由離子在電極內(nèi)部的擴(kuò)散控制;
4、τ≤L2/D,L為離子擴(kuò)散長(zhǎng)度;
5、電極材料的電子 電導(dǎo)遠(yuǎn)大于離子電導(dǎo)等條件
計(jì)算公式如下:
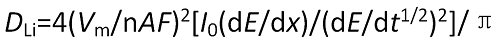
式中,DLi為“在電極中的化學(xué)擴(kuò)散系數(shù),Vm為活性物質(zhì)的體積,A為浸入溶液中的真實(shí)電極面積,F(xiàn)為法拉第常數(shù),n為參與反應(yīng)的電子數(shù)目,I0為滴定電流值,dE/dx為開路電位對(duì)電極中Li濃度曲線上某濃度處的斜率(即庫(kù)侖滴定曲線),dE/dt1/2為極化電壓對(duì)時(shí)間平方根曲線的斜率。
利用GITT方法測(cè)量電極材料中的鋰化學(xué)擴(kuò)散系數(shù)基本過程如下:在電池充放電過程中的某一 時(shí)刻,施加微小電流并恒定一段時(shí)間后切斷;記錄電流切斷后的電極電位隨時(shí)間的變化;做出極化電壓對(duì)時(shí)間平方根曲線,即dE/dt1/2曲線;測(cè)量庫(kù)侖滴定曲線,即dE/dx曲線;代入相關(guān)參數(shù),利用公式求解擴(kuò)散系數(shù)。
恒電勢(shì)間歇滴定技術(shù)
恒電位間歇滴定技術(shù)(potentiostatic intermittent titration technique)是通過瞬時(shí)改變電極電位并恒定 該電位值,同時(shí)記錄電流隨時(shí)間變化的測(cè)量方法。 通過分析電流隨時(shí)間的變化可以得出電極過程電位弛豫信息以及其它動(dòng)力學(xué)信息, 類似于恒電位階 躍,只是PITT是多電位點(diǎn)測(cè)量。
使用恒電位間歇滴定技術(shù)測(cè)量鋰離子化學(xué)擴(kuò)散系數(shù)公式如下:

式中,i為電流值,t為時(shí)間,△Q為嵌入電極的電量,DLi為L(zhǎng)i在電極中的擴(kuò)散系數(shù),d為活性物質(zhì)的厚度。
基本操作如下:以恒定電位步長(zhǎng)瞬間改變電 極電位,記錄電流隨時(shí)間的變化;利用ln(i)一t曲線;截取ln(i)一t曲線線性部分的數(shù)據(jù),求斜率即可求出鋰離子化學(xué)擴(kuò)散系數(shù)。
電位弛豫技術(shù)
電位弛豫技術(shù)(potential relax technique)是在電池與外界無物質(zhì)和能量交換的條件下研究電極電 勢(shì)隨時(shí)間的變化關(guān)系,該方法屬于電流階躍測(cè)量方 法中的斷電流法,與GITT實(shí)驗(yàn)方法一致,不同的是分析弛豫過程中的電位變化。該方法最早由中國(guó)科學(xué)院物理研究所王慶等運(yùn)用于鋰離子電池電極材料中的離子擴(kuò)散動(dòng)力學(xué)研究。
計(jì)算公式為:

式中,ψm為平衡電極電位,ψ為初始電位,R 為氣體常數(shù),T為絕對(duì)溫度,d為活性物質(zhì)的厚度,DLi為L(zhǎng)i在電極中的擴(kuò)散系數(shù),t 為電位達(dá)到平衡時(shí)的時(shí)間。
具體測(cè)量步驟如下:對(duì)電池預(yù)充放電,使電池的庫(kù)侖效率降至97%左右;在電池充/放電到一 定程度時(shí),切斷電流,采用CPT(chrono potentiometry technique)記錄電壓隨時(shí)問的變化曲線;運(yùn)用公式對(duì)ln[exp(ψm-ψ)xF/RT-1]-t作圖,并對(duì)后半部分作線性擬合;ln[exp(ψm-ψ)xF/RT-1]-t曲線進(jìn)行擬合,求解擬合曲線斜率,帶公式即可求得鋰的化學(xué)擴(kuò)散系數(shù)。
運(yùn)用電位弛豫技術(shù)測(cè)量電極過程動(dòng)力學(xué)信息 需要滿足一定的前提條件。通常,鋰離子電池在首 周充放電過程中伴隨著一些副反應(yīng),典型的副反應(yīng) 為SEI膜的形成,為避免副反應(yīng)的發(fā)生對(duì)鋰離子化 學(xué)擴(kuò)散系數(shù)測(cè)量所帶來的干擾,通常電池需要進(jìn)行 幾個(gè)充放電循環(huán)之后開始測(cè)量其化學(xué)擴(kuò)散系數(shù)。此 外,由于電位弛豫是一個(gè)非常緩慢的過程,一般在 8 h左右,在經(jīng)過長(zhǎng)時(shí)間的弛豫后,電位仍不能達(dá)到平衡狀態(tài),則有可能是儀器漏電所造成,需要特別注意。
-
鋰電池
+關(guān)注
關(guān)注
259文章
8042瀏覽量
169604 -
電極
+關(guān)注
關(guān)注
5文章
807瀏覽量
27167
原文標(biāo)題:【干貨】由淺入深——解析鋰電池電化學(xué)測(cè)量方法(總結(jié))
文章出處:【微信號(hào):Recycle-Li-Battery,微信公眾號(hào):鋰電聯(lián)盟會(huì)長(zhǎng)】歡迎添加關(guān)注!文章轉(zhuǎn)載請(qǐng)注明出處。
發(fā)布評(píng)論請(qǐng)先 登錄
相關(guān)推薦
電化學(xué)原理介紹和分析方法
鋰電池的等效阻抗及測(cè)量方法
電化學(xué)檢測(cè)器有什么功能?
基于電化學(xué)傳感器的Arduino兼容電化學(xué)氣體檢測(cè)電路CN0357
電化學(xué)傳感器的發(fā)展怎么樣?
電化學(xué)工作站有什么功能?
電化學(xué)-電池與電解
電化學(xué)方法_原理和應(yīng)用_(第2版)
鋰電池高溫存放后的電化學(xué)容量衰減解析

電化學(xué)知識(shí):電化學(xué)的應(yīng)用與三電極體系!
干貨 | 鋰電池正極材料理化性能和電化學(xué)性能的分析方法綜述
電化學(xué)阻抗譜法的基本原理 EIS在鋰電池狀態(tài)檢測(cè)中的應(yīng)用
鋰電池極片設(shè)計(jì)及表面缺陷對(duì)電池電化學(xué)性能的影響分析
鋰電池儲(chǔ)存庫(kù)和電化學(xué)儲(chǔ)能電站應(yīng)配置的消防設(shè)施包括哪些?





 干貨分享鋰電池電化學(xué)測(cè)量方法
干貨分享鋰電池電化學(xué)測(cè)量方法










評(píng)論