【背景介紹】
細胞裂解是獲取細胞內蛋白,細胞器以及遺傳物質等物質的關鍵步驟。通常,細胞裂解可通過物理方法,化學方法以及生物方法來實現,例如超聲裂解,酸堿裂解和酶裂解等。這些方法通常需要大量的細胞樣品或較長的裂解處理時間,這對其應用產生了限制。近年來基于微流控的細胞裂解方法發展迅速,為微量細胞樣品快速高效裂解提供了平臺。雖然在微升液滴尺度上進行實驗可以顯著地降低樣本的消耗以及裂解所需要的時間,但是這些方法通常也需要外電場或者裂解酶等特定結構或試劑來輔助裂解,其集成性和應用性依然受限。因此生物檢測領域對于具有普適性的微量細胞快速裂解的方法依然有迫切需求。
近年來,基于聲表面波的微流控技術在細胞分選以及生化傳感方面大放異彩。聲表面波是一種由射頻信號在壓電基片上激發的彈性波,其波長處于微米量級,是一種理想的在微納米尺度進行細胞操控和處理的工具。目前,基于聲表面波的微量細胞裂解方法主要是通過聲場中的剪切力裂解以及聲壓裂解來實現,可以在高功率下實現有效的細胞裂解。然而,為獲得剪切力需要構建的聲子晶體結構制備復雜,而聲壓破碎又有相當大的功耗以及不穩定性,導致其在進一步集成應用上具有較大限制。因此,如果能夠通過引入納米或者微米量級的顆粒,使其與尺寸相近的細胞進行相互作用,由此產生的相互作用力就有望使細胞在較低的功率下實現裂解,實現低成本的細胞裂解,將會具有非常大的實用意義。
【成果簡介】
近日,中央民族大學耿照新教授、中科院半導體所陳弘達研究員和山東大學劉宏教授聯合設計了一種聲表面波細胞裂解器件,可以實現多種細胞在微量液滴中的高效裂解,并對裂解原理和機制進行了詳細的闡釋介紹。該器件僅由壓電基片鈮酸鋰(LiNbO3)襯底及其上的一對平行叉指電極(IDTs)和一端的雙層3M膠帶組成,其中叉指電極周期為120 mm,為了減少雜波生成,在叉指電極上設計了80個聲波周期。進行裂解時,僅需在膠帶前滴加5-20 mL包含有微粒和細胞的混合液滴,隨后通過可調節的信號源在基片上產生行波聲表面波,在基片上傳播的聲表面波將會耦合到含有微米顆粒和細胞的液滴中,產生聲流場,帶動聲流場中的微粒和細胞運動。由于微粒和細胞具有不同的物理性質,在曳力作用下產生不同的加速度,因而在聲流場中反復經歷加速、碰撞和再加速的過程,在細胞-微粒界面處由于碰撞時巨大的動量交換產生強大的相互作用力使得細胞膜功能喪失,實現細胞裂解。經過對試驗條件的優化和多種細胞裂解的嘗試,找到了最優的裂解條件,實現了100%的細胞裂解。通過細胞膜胞內蛋白以及細胞核的三種熒光的裂解前后熒光對比證明了細胞裂解后胞內蛋白得到有效釋放,可用于后續生化傳感過程。針對不同種類微粒的裂解實驗,通過掃描電鏡圖片捕捉并且通過模型還原了碰撞界面以及碰撞過程,通過流體動力學計算估算了不同細胞和微粒在聲流場中的受力分析及加速度參數。通過與其他微量細胞裂解方法比較,說明了該方法在微量細胞裂解中具有巨大新意以及應用價值。研究成果以題“Piezoelectric Microchip for Cell Lysis through Cell-Microparticle Collision within a Micro Droplet Driven by Surface Acoustic Wave Oscillation”作為封底(Back Cover)發表在Small上。該成果在學術流中得到眾多學者認可,并有多位學者要求進行合作,開展其在“干細胞、神經元細胞”、“外泌體、微泡”、“蛋白、MircoRNA”等方面的研究。
本文第一作者是山東大學博士生王世才,在耿照新教授負責的“新材料與新器件”小組開展具體工作,劉宏教授也參與全程指導。本項工作受到國家重點研發計劃“聲表面波材料與器件”以及“微納生化傳感材料與器件”的支持。
【圖文導讀】圖一、器件制備和表征
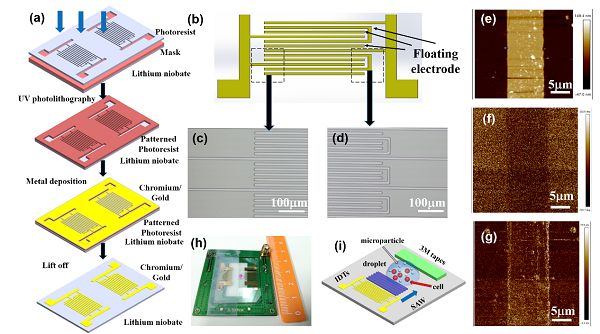
(a)器件制備示意圖。
(b)電極設計示意圖。
(c)電極光刻顯微鏡圖像。
(d)電極光刻顯微鏡圖像。
(e)壓電力顯微鏡(PFM)圖片。
(f)PFM下的振幅高度。
(g)PFM下的相位圖。
(h)器件實物圖。
(i)器件示意圖。
圖二、裂解原理
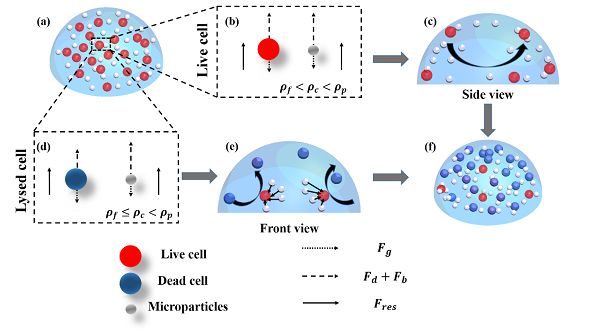
(a)裂解前液滴中微粒與細胞分布。
(b)活細胞受力分析。
(c)聲場中細胞與微粒受力與運動側視圖。
(d)死細胞受力分析。
(e)聲場中細胞與微粒受力與運動主視圖。
(f)裂解后細胞與微粒在液滴中的分布。
圖三、裂解影響因素的探索
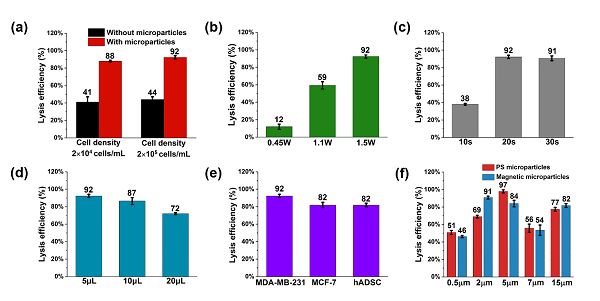
(a)在直徑為4 mm的磁珠存在與否的情況下的細胞裂解效率。
(b)不同裂解功率下細胞的裂解效率。
(c)不同裂解時間下的細胞裂解效率。
(d)不同液滴體積下的細胞裂解效率。
(e)相同條件下,MDA-MB-231,MCF-7和hADSCs的裂解效率。
(f)直徑為0.5, 2, 5, 7, 15 mm的PS球和磁珠的顆粒的細胞裂解效率。
圖四、細胞裂解前后的熒光染色圖片。
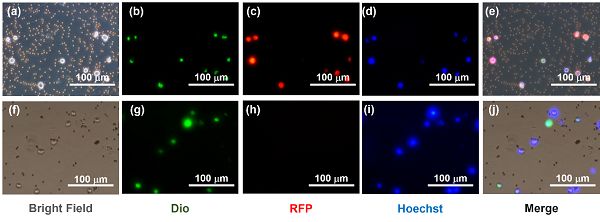
(a)細胞裂解前的明場圖片。
(b)細胞裂解前的Dio細胞膜染色圖片。
(c)細胞裂解前的RFP胞內蛋白分布圖片。
(d)細胞裂解前的Hoechst細胞核染色圖片。
(e)細胞裂解前的疊加圖片。
(f)細胞裂解后的明場圖片。
(g)細胞裂解后的Dio細胞膜染色圖片。
(h)細胞裂解后的RFP胞內蛋白分布圖片。
(i)細胞裂解后的Hoechst細胞核染色圖片。
(j)細胞裂解后的疊加圖片。
圖五、不同種類和尺寸下裂解細胞的掃描電鏡圖像及其對應的模型分析
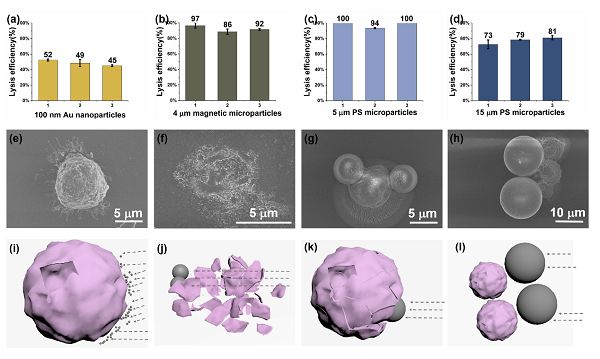
(a)100 nm Au顆粒作用下的細胞裂解效率。
(b)4 mm磁珠作用下的細胞裂解效率。
(c)5 mm聚苯乙烯微流(PS)作用下的細胞裂解效率。
(d)15 mmPS作用下的細胞裂解效率。
(e)100 nm Au顆粒作用下的細胞掃描電鏡圖片。
(f)4 mm磁珠作用下的細胞掃描電鏡圖片。
(g)5 mmPS作用下的細胞掃描電鏡圖片。
(h)15 mmPS作用下的細胞掃描電鏡圖片。
(i)100 nm Au顆粒作用下的細胞裂解碰撞模型。
(j)4 mm磁珠作用下的細胞裂解碰撞模型。
(k)5 mmPS作用下的細胞裂解碰撞模型。
(l)15 mmPS作用下的細胞裂解碰撞模型。
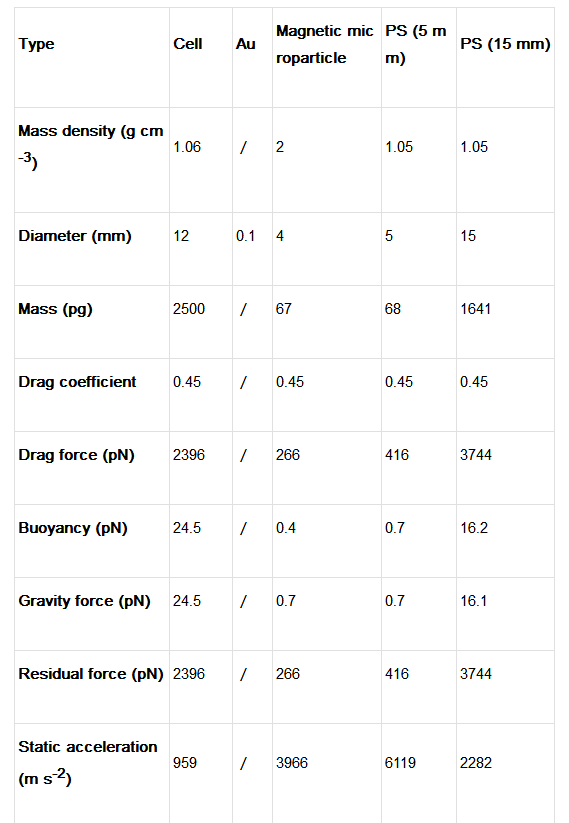
表一、微粒參數和流體力學分析
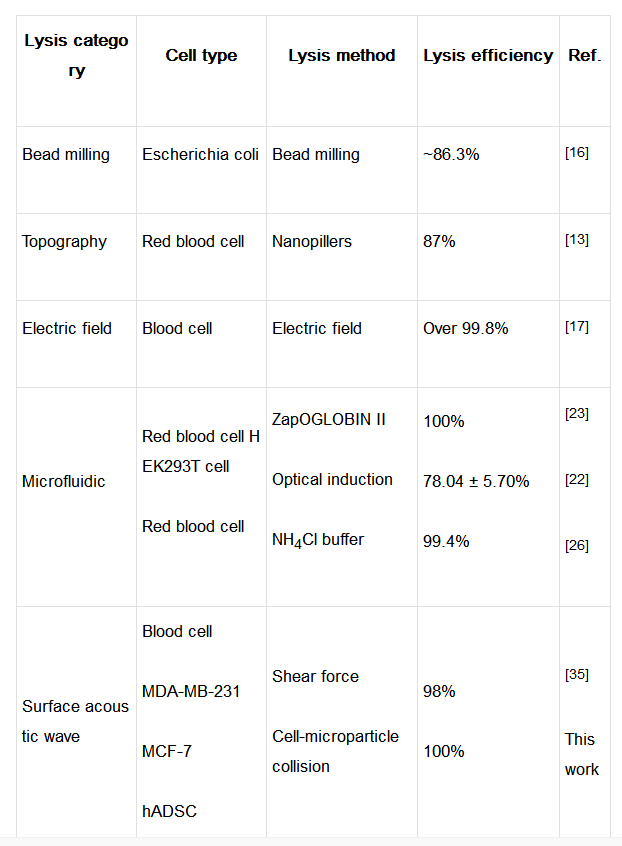
表二、與其他微量細胞裂解方法的效率對比
【小結】
總的來說,研究人員通過向含有細胞的液滴中引入微米顆粒,利用聲場對細胞和微粒的不同加速作用實現了細胞和微粒的碰撞,實現細胞的高效裂解。熒光實驗證明經過裂解,胞內蛋白得到有效釋放,為胞內物質檢測提供良好的基礎。因此,作為一種新型微量細胞裂解方法,該器件在癌癥檢測,細胞組分分析,干細胞研究等方面具有關鍵性的意義。
-
半導體
+關注
關注
334文章
27006瀏覽量
216273 -
射頻信號
+關注
關注
6文章
214瀏覽量
20832 -
微納米
+關注
關注
0文章
18瀏覽量
7561
原文標題:Small:聲表面波驅動的微液滴中細胞微粒碰撞致細胞裂解的壓電微芯片
文章出處:【微信號:Micro-Fluidics,微信公眾號:微流控】歡迎添加關注!文章轉載請注明出處。
發布評論請先 登錄
相關推薦
集成電路設計基礎.ppt(山東大學教程)
中科院剖析 LED怎樣克服困難
聲表面波無源無線傳感器詳解
山東大學-算能RISC-V研究院正式揭牌,助推集成電路產業新發展!
山東大學選購我司一批熱分析儀設備

致謝山東大學:攜手并進,共創輝煌





 中科院半導體所和山東大學聯合設計了一種聲表面波細胞裂解器件
中科院半導體所和山東大學聯合設計了一種聲表面波細胞裂解器件












評論