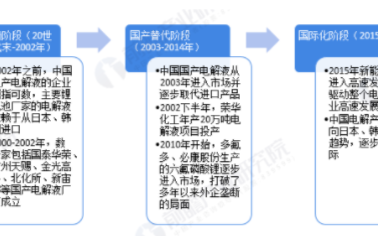
研究背景
在醚類電解液中,鋰硫/硒(Li-S/Se)電池發生“固-液-固”反應機制,產生可溶的多硫化物Li2S4-8(LPSs)/多硒化物Li2Se4-8(LPSes)中間產物。這種機制會不利于電池電解液用量的進一步減少,從而弱化Li-S/Se電池在能量密度方面的優勢。使用抑制 LPSs/LPSes溶解的低溶劑化電解質AN2(AN與LiTFSI摩爾比為2,簡稱AN2),可以減少電解質用量。但是低溶劑化電解質反應動力學緩慢,并且與鋰金屬的兼容性差。
成果簡介
近日,華中科技大學伽龍教授通過調節電解質結構,發現在弱溶劑化電解質AN3(AN與LiTFSI摩爾比為3,簡稱AN3)中,LPSs/LPSes溶解度略高于低溶劑化電解質,可以促進電化學反應,并穩定鋰負極。在高電流密度、高負載和貧電解液 (E/A) 的條件下,AN3電解質可實現高活性材料利用率。
在0.1 C時,采用SeS2正極的電池的放電容量為1047 mAh g-1(理論容量1123 mAh ?1的93.2%)。即使采用高負載SeS2正極(9.5?mg cm?2)和超低E/A(1?μL mg?1)條件下,使用AN3電解液的電池可逆容量仍達到713 mAh g?1。
研究亮點
(1) 提出了一種弱溶劑化電解質AN3(AN:LiTFSI 1:3摩爾比)來實現高比能 LiSeS2電池。
(2) 弱溶劑化電解質AN3改變了反應路徑,促進了SeS2?正極的轉化。
(3) 部分溶劑化的中間體有助于在鋰負極上形成堅固的 SEI。
(4) 在 1 μL mg-1?的貧電解質條件下,實現了具有 7.0 mAh cm-2?高負載的可逆 Li-SeS2電池。
圖文導讀
為了使用AN作為鋰金屬電池電解質的溶劑,增加鋰鹽濃度是有效解決方案,高濃鹽可以使游離AN分子與Li+離子配位。為了確定需要多少鹽來保證對Li金屬的還原穩定性,將新鮮的鋰箔浸入AN溶劑和AN溶液中(ANx,這里x是指AN與LiTFSI的摩爾比),并監測溶液的顏色變化。純AN溶劑在1小時后變為淡黃色,稀釋溶液(AN4)在1天后變為黃色,顏色變化是由于Li和AN分子之間的反應。而鋰箔在AN2和AN3電解質中即使在10天后也保持透明。
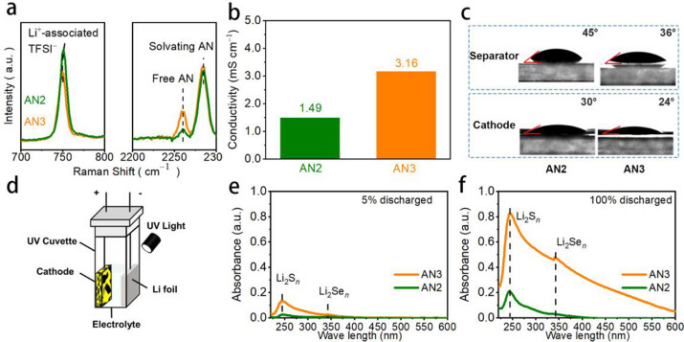
圖1. AN2和AN3電解液的物化性質比較。(a)拉曼光譜,(b)電導率,(c)電解液在隔膜和正極上的接觸角,(d)用于原位UV-Vis表征的比色池的示意圖,以及(e)5%和(F)100%放電深度下的UV-Vis光譜。
與以前文獻中常用的AN2相比,AN3顯示與Li+離子配位的TFSI?的拉曼光譜峰更低(749?cm?1),有更強的自由-AN峰(如2258 cmν1的≡C?N伸縮振動),表明AN3中有更多的自由Li+離子和AN分子(圖1a)。這種電解液結構的變化使AN3在不同溫度下具有更高的離子電導率(圖1b)。此外,隨著游離AN分子的增加,AN3與隔膜和SeS2正極的潤濕性更好(圖1c)。以上物理化學性質證實了AN3作為鋰金屬電池電解液的優越性。
額外的游離AN分子還賦予AN3作為Li-S(Se)電池電解質的其它優點。一個明顯的例子是它對LPSs/LPSes更高的溶解度,這有利于電池的高倍率能力。為了研究AN2和AN3之間的溶解度差異及其對電化學行為的影響,作者設計了一個比色池(圖1d),并在放電過程中原位監測電解質的UV-vis光譜,其峰強度與溶質的濃度呈線性關系。
圖1e觀察到位于242?nm和340?nm的兩個主要吸收帶,其分別對應于可溶性LPSs和LPSes。AN3中LPSs的峰值強度是AN2的5倍,表明AN3中形成了更多的可溶性LPSs,并且在放電過程開始時產生了兩種電解質之間的溶解行為的差異。在放電結束時(100%放電,圖1f),盡管兩種電解質的峰強度增加,但在AN2仍然難以觀察到340 nm吸收帶(LPSes的峰)。
電化學過程中AN3中LPSes的形成可能有利于Li金屬負極的穩定性。基于原位UV-vis結果,清楚地證明了AN3中比AN2中有更多的溶劑化中間產物。微溶劑化電解質(如AN2)代表飽和電解質,其中的中間體很難溶解。弱溶劑化電解質(如AN3)代表濃縮電解質,其含有比游離AN2更多的配位AN,反應產生的中間產物可以輕微溶解。
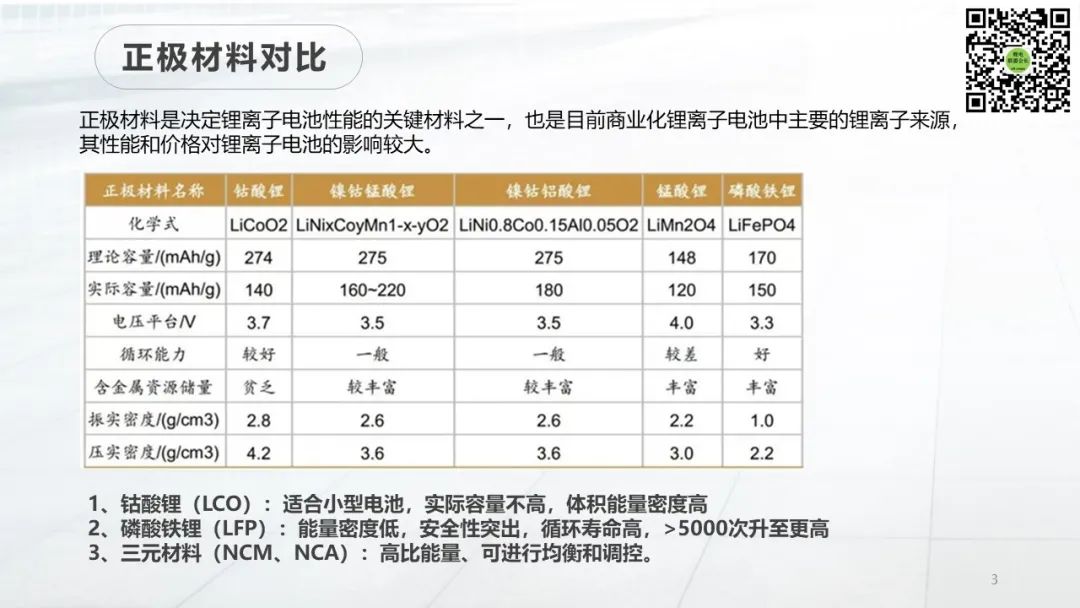
作者選擇SeS2作為正極活性材料,因為硒的電導率(10-5 S cm-1)遠高于硫的電導率(5×10 -30?S cm-1),將硒引入硫正極可以提高電極的電導率,這對于促進Li-S/Se電池的反應至關重要,尤其是在使用低溶劑電解質時。SeS2顯示出與Se和S的XRD不同的X射線衍射(XRD)圖,證實了在加熱過程之后形成了新的相。
得益于將高導電Se結合到S電極中,Li-SeS2電池在AN3電解液中顯示出比Li-S電池(0.70?V)更低的放電-充電極化(0.28?V)。此外,在AN3電解液中,Li-SeS2電池比Li-S電池表現出更好的循環穩定性,盡管其在前40次循環中的放電容量較低。這種循環穩定性的顯著提高可歸因于LiSeS2電池的Li負極在AN3電解質中的穩定性增加。
在AN3電解液中加入硒元素不僅提高了正極的電導率,而且允許更多的多硒化物溶解,這些多硒化物既是重要的氧化還原介質,又有助于形成穩定的SEI。
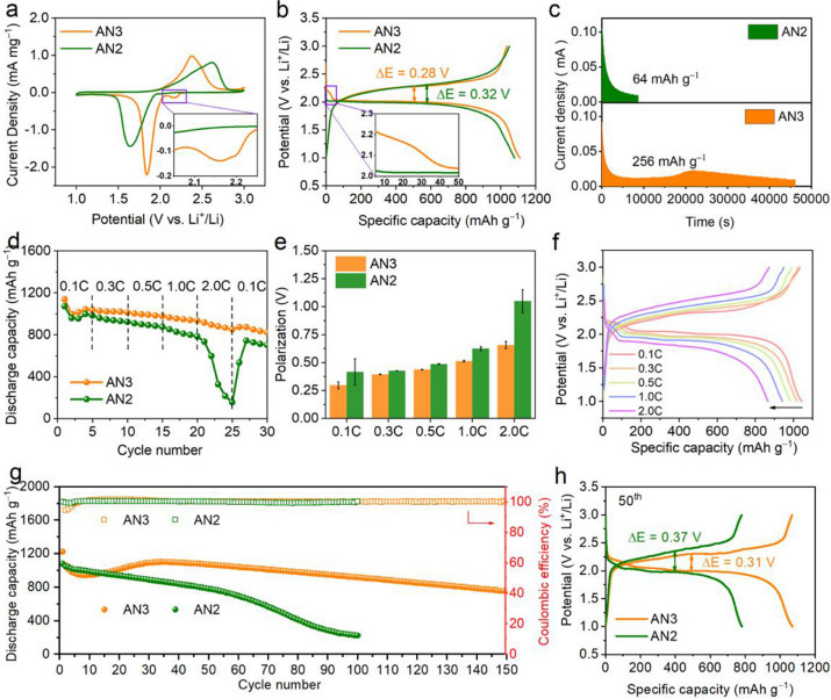
圖2.?在AN2和AN3電解液中,Li-SeS2電池的電化學行為比較。(a)在0.1?mV s?1掃描速率下的CV曲線,(b)在0.1?mA cm?2電流密度下的放電充電曲線,(c)恒壓2.1V放電曲線,(d)倍率性能,(e)過電位,(f)0.1,0.3,0.5,1和2C(1C=1123 mA g?1)下的放電/充電曲線,(g)在0.1?mA cm?2電流密度下的循環性能,以及(h)第50個循環的相應放電-充電曲線。
用掃描速度為0.1 mV S-1的循環伏安法(CV)研究了AN2和AN3中Li-SeS2電池的電化學動力學。與AN2的CV曲線相比,AN3中的電池顯示位于2.16V的額外還原峰?(圖2a),這是由于AN3中LPSs/LPSes中間體的形成和溶解。這樣的結果與原位UV-vis表征一致(圖1d-f)。
相比之下,由于LPSs/LPSes在AN2的低溶解度,AN2的Li-SeS2電池僅顯示一個放電平臺,這意味著固-固轉換機制(圖2b)。游離AN溶劑的引入將低溶劑化的AN2電解質轉變為弱溶劑化的AN3電解質,并允許部分活性材料參與電化學過程中的溶解沉淀反應,這將反應極化從0.32降低到0.28?V,而沒有容量損失。
電化學阻抗譜(EIS)進一步證實了AN3中Li-SeS2電池反應動力學的改善。通過在2.1?V下恒壓放電實驗,以了解放電過程中固體SeS2到LPSs/LPSes中間體的溶劑化過程。AN3電池的恒電位放電時間為46135 s,容量為256 mAh g-1,遠高于AN2電池(8672 s和64 mAh g-1)。此外,與AN2相比,AN3中的電池在21481?s處觀察到明顯的還原電流峰,這證實了在AN3中,Li-SeS2電池在放電期間的溶劑化過程增加(圖2c)。
AN3中LPSs/LPSes中間體的溶劑化增加使得Li-SeS2電池具有超高倍率性能。圖2e比較了在0.1C至2C(1C = 1123 mA g-1)范圍內,AN2和AN3中Li-SeS2電池的倍率性能。在AN3中,Li-SeS2電池在0.1?C時表現出1047 mAh g-1的高容量,相當于理論值的93.2%,即使當電流密度增加到2.0?C時,仍可保持851 mAh g-1的穩定容量(圖2d)。
相比之下,在AN2電解質中的電池在2.0?C下經歷快速容量衰減。同時,電解質從微溶劑化的AN2到弱溶劑化的AN3的調節降低了充電-放電極化,在2.0 C高倍率下,AN2對于AN3的極化從1.05?V降低到0.65?V (圖2e和2f)。
以0.1 mA cm?2的電流密度循環測試,研究了Li-SeS2電池在AN2和AN3中的長循環性能。如圖2G所示,AN3中的電池表現出良好的循環性能,135次循環后保持了800 mAh g?1的高可逆容量,對應于每循環0.25%的低容量衰減率。相比之下,AN2中的電池容量衰減很快,75次循環后容量為490 mAh g?1,100次循環后容量為223 mAh g?1。
研究還發現,在AN3中,電池的庫侖效率(CE)保持在99%以上,表明在電化學過程中,即使有更多的LPSs/LPSes溶解在AN3中,中間產物的“穿梭效應”也可以忽略不計。
圖2h比較了在第50個循環時,Li-SeS2電池的放電-電壓分布,在AN3中的極化是0.31V,容量為1071mAh g?1,甚至低于AN2中第一個循環的極化(0.32V)。同時,AN2中電池的極化從第一個循環的0.32V?增加到 50 個循環后的 0.37V,電壓極化的變大可能解釋了AN2中的電池容量損失(從第一個循環的1079mAh g?1到50個循環后的781mAh g?1)。
綜上,電化學極化、倍率能力和循環性能的改善可以歸因于LPSs/LPSes在AN3中的溶解度增加,從而促進了中間產物在電化學過程中的溶劑化,改善了反應動力學。
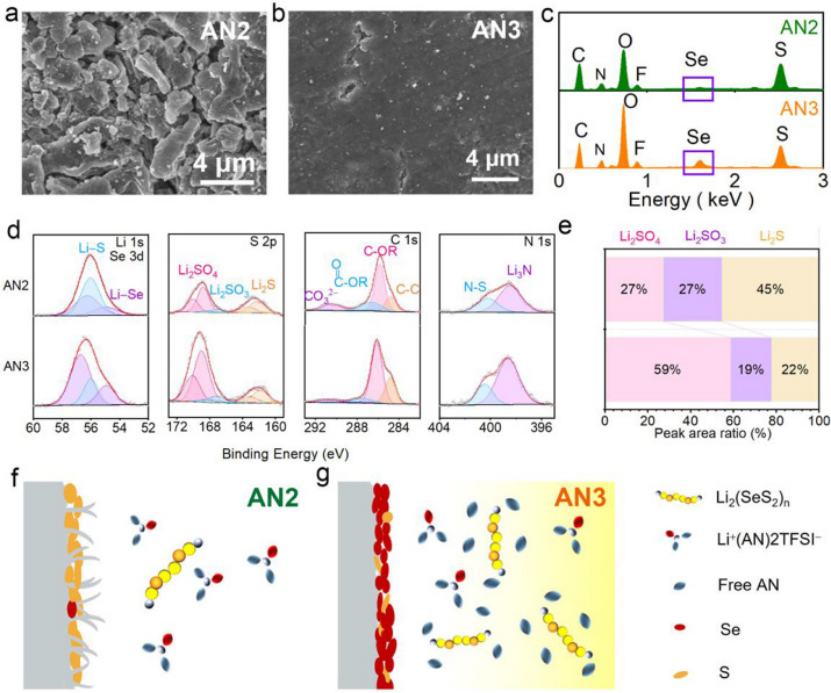
圖3.在(a)AN2和(b)AN3中,在100次循環后的鋰負極表面形貌,以及(c)相應的EDS結果。(d)Li 1s、S?2p、C?1s、N?1s的XPS,以及(e)在AN2和AN3電解液中循環3次后,Li-SeS2電池中含S的Li金屬負極物種的相對組成。(F)AN2和(G)AN3中鋰負極上的SEI形成示意圖。
為了研究電解液對鋰負極穩定性的影響,在AN2和AN3中拆解了循環后的Li-SeS2電池,并用SEM比較了循環后的Li負極的形貌。在AN2中循環的鋰負極僅在三次循環后就顯示出多孔疏松的結構(圖S14a),而在AN3中,循環的鋰負極沉積光滑致密,沒有鋰枝晶。100次循環后,AN3中的鋰負極保持致密(圖3b),而在AN2中鋰沉積的形貌為單獨的顆粒狀?(圖3a)。上述結果證實,通過將電解液的溶劑化性能從稀溶化調整為弱溶劑化,鋰負極的循環穩定性顯著提高,這也有助于Li-SeS2電池的長期穩定性。
為了弄清電解液如何影響鋰陽極上SEI的形成,用能譜儀(EDS)檢測了循環鋰負極的元素分布。如圖3c所示,AN3中循環鋰負極的能譜顯示出更強的Se峰。Se元素含量的增加可以歸因于AN3中可溶性LPSes的增加,富Se的SEI層一直被認為有利于鋰負極的穩定性。
用X射線光電子能譜(XPS)進一步表征了循環鋰負極的SEI組成。圖3D比較了AN2和AN3電解液中形成的SEI的Li 1s、S 2p、C?1s和N?1s譜。兩種電解液中循環鋰負極的Li?1s峰分別對應于Li-Se鍵的56.7和54.9?eV。根據峰面積比,AN3循環后的鋰表面上的Se原子濃度遠遠高于AN2電解液中的Se原子濃度。
電解液中的硫元素可以從LiTFSI鹽和可溶性LPS中獲得,而Se元素只能從電解液中的可溶性LPS中找到。因此,可以再次證實,在AN3中循環的鋰負極中Se含量較高是由于從稀溶化AN2到弱溶劑化AN3電解液中可溶性中間產物的增加。
在S 2p中可以發現在兩種電解質在鋰負極界面的另一個明顯差異。在AN3中形成的SEI中SO42-的峰高于AN2。LiSO4?可以有效保護 Li 表面免受 AN 分子的腐蝕,從而延長鋰的使用壽命。Li2SO4組分對于鋰金屬上穩定的SEI是有益的,并且對電池的循環能力很重要。
根據峰面積比計算AN2循環鋰負極SEI中Li2SO4的含量,Li2SO4中S的原子濃度為59%,幾乎是AN2的兩倍(圖3e)。而對于在AN2中循環的鋰負極,SEI包含更多的CO32?,這是由于Li負極和AN2電解質之間的連續反應,導致氣體生成和對SEI的破壞,因此循環穩定性較差。對于N?1s光譜,AN3中的SEI含有更多的Li3N(398.6?eV),Li3N不僅增加了SEI的機械強度,而且還表現出高Li離子電導率,有助于均勻和快速的Li+離子通量。
這些結果表明,自由AN分子和溶解的LPSs/LPSes之間的共反應在AN3中形成了致密光滑的SEI層。隨著Li2SO4和Li3N的增加,在AN3中形成的SEI層更加光滑和致密,實現了均勻和快速的Li鍍/剝離。
為了進一步確認SEI層的功能,組裝了不對稱的Li||Li電池。具有新鮮Li片的Li||Li電池僅在15小時后就顯示出巨大的極化波動,這表明Li負極和AN3之間發生了劇烈的副反應,表明在AN3中的Li-SeS2電池中形成的SEI層有效地穩定了Li負極的循環穩定性。
如圖3f和3g所示,用于解釋微溶劑化AN2和弱溶劑化AN3電解質中SEI的形成。在AN2中,所有溶劑分子都與LiTFSI配位形成Li+(AN)2TFSI。由于缺少游離AN分子,LPSs/LPSes中間產物的溶解變得困難,從而導致Li-SeS2電池在AN2中的“固態”反應途徑受阻。
在這種微溶劑化電解質中,鋰負極表面形成的SEI層疏松不穩定,導致電池循環穩定性差。在AN3?中,增加的游離 AN 分子允許溶解更多的 LPSs/LPSes?中間體,Li-SeS2電池經歷LPSs/LPSes中間產物的轉化過程。溶解的LPSs/LPSes中間產物促進了 S (Se) 與其放電產物之間的轉化,并有助于在鋰負極表面形成堅固穩定的 SEI層,從而延長循環壽命,并提高倍率性能。
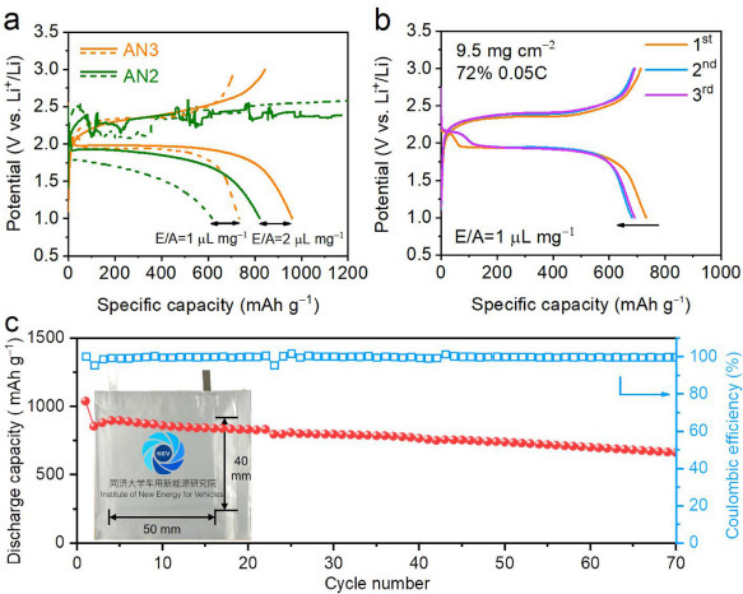
圖 4. (a) 在 AN2和AN3?電解質中,負載為 9.5 mg cm?2、E/A?比為?1 和?2 μL mg?1?的 Li-SeS2?電池的放電-充電曲線,(b)在 AN3?電解質中, E/A 比為 1 μL mg?1?的情況下,Li-SeS2?電池前三個循環的放電-充電曲線,以及 (c) Li-SeS2軟包電池的循環性能,插圖為電池圖片。
如圖4a所示,在高負載(9.5?mg cm?1)?和高活性材料含量(72 wt%)的SeS2正級中,在E/A比為2 μL mg?1條件下,使用AN3的電池獲得844 mAh g?1的可逆容量,相當于活性物質利用率為79%。
即使在極低E/A比為1 μL mg?1的苛刻測試條件下,可逆容量也可達到713 mAh g?1。在考慮正極、正極集流體、負極和電解質的質量條件下,也可以達到370 Wh kg-1的能量密度。當E/A比增加到3 μL mg?1時,穩定循環容量為734 mAh g?1。AN2中的Li-SeS2電池無法在1 μL mg?1的E/A比下完成充電過程。如圖4c所示,軟包電池中AN3電解質具有662 mAh g?1的高容量,每圈容量衰減率為0.5%,顯示了AN3在實際應用中的巨大潛力。
總結與展望
通過在微溶劑化的AN2電解質中引入更多的游離AN分子,成功地調節了以AN為溶劑的電解質的結構和溶劑化行為。新配制的弱溶劑化電解質AN3增加了LPSs/LPSes中間體的溶解度,并促進了Li-SeS2電池的放電-充電反應。此外,在溶解的中間產物的幫助下,在鋰負極表面上生成了堅固穩定的SEI層,這保證了Li-?SeS2電池的長期循環穩定性。即使在極低E/A比(1 μL mg?1)?和高活性負載/含量(9.5?mg cm?2?72wt%),Li-?SeS2電池仍能實現713mAh g-1的高可逆容量。這項工作為開發具有高能量密度和長循環穩定性的Li-S(Se)電池開辟了可能性。
審核編輯:劉清
 電子發燒友App
電子發燒友App






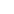



















評論