研究背景
作為最先進、最便攜的儲能裝置,鋰離子電池(LIBs)推動了電動汽車(EVs)的快速發展。然而,當前電動汽車的一個主要缺點是充電慢。為此,美國能源部提出了“極速充電”(XFC)的目標,要求充電時間縮短為15分鐘(4C)。到目前為止,使用石墨負極和碳酸亞乙酯(EC)基電解質的商業LIB無法實現極速充電,因為在高倍率下,石墨的工作電位很容易降至0 V,導致負極析鋰。因此,需要改善Li+在電解質中的傳輸動力學,從而實現石墨負極的極速充電,同時避免鋰金屬的沉積。
成果簡介
近日,浙江大學范修林教授,馬里蘭大學王春生教授和中國科學院物理研究所王雪鋒研究員在Advanced Materials上發表了題為“50C fast-charge Li-ion batteries using graphite anode”的論文。該論文設計了一種新型電解質,可以在避免析鋰的情況下,對微尺寸石墨負極進行極速充電。實驗表征和模擬表明,高離子電導率、低鋰離子去溶劑化能和具有保護作用的SEI對極速充電至關重要。
根據該標準,設計了兩種快速充電電解質:1.8 M LiFSI in?DOL和1.0 M LiPF6?in FEC/AN(體積比為7:3)。在50C時,前一種電解質使石墨電極容量達到180 mAh g-1,是傳統電解質的10倍。在4C充電和0.3C放電條件下,后一種電解質使LiNi0.8Co0.1Mn0.1O2||石墨電池提供高達170 mAh g-1的可逆容量。
研究亮點
(1)本工作證明了降低Li+在電解質中的去溶劑化能有望實現快速的界面動力學,而提高電解質的離子電導率和形成薄而堅固的SEI可以實現具有良好循環穩定性的超高倍率石墨負極。
(2)理論計算和實驗結果表明,1.8 M LiFSI in?DOL電解液使微尺寸天然石墨(NG)電極在20C下實現了315 mAh g-1的容量,且沒有衰減。即使在50C 下,仍保持180 mAh g-1的高可逆容量。在-30℃下,可逆容量為310 mAh g-1。
圖文導讀
儲能速率取決于Li+在正負極之間的遷移速度。原則上,Li+在充電過程中經歷三個步驟(圖1a):(a)溶劑化Li+在體電解質中的擴散,(b)Li+去溶劑化,(c)Li+穿過SEI。溶劑的物理化學性質和濃度決定了Li+的擴散率,而Li+內溶劑化殼的成分影響SEI的組成,從而決定SEI中的Li+傳輸動力學。加速Li+傳輸將顯著增強電化學動力學,這需要具有高離子電導率(IC)、低去溶劑化能(ΔEdsv)和低Li+遷移能壘(ΔESEI)和小的面積比電阻(ASR)。
為了設計具有這些特性的電解質,首先通過實驗和DFT計算測量常用鹽和溶劑的離子電導率(圖1b)、ΔEdsv(圖1c)和還原電位(Gred,圖1d)。根據結果,FSI-在陰離子中表現出最低的ΔEdsv(圖1c)和最高的還原電位(圖1d),表明FSI-可以實現低的去溶劑化能壘和富含無機物的SEI。
對于溶劑,AN基電解質表現出優異的離子電導率,可增強電解質內的Li+遷移和傳輸(圖1b),而與Li+相互作用最弱的DOL溶劑(圖1c)有望改善去溶劑化動力學。FEC溶劑有利于構建富含LiF的SEI,因為它可以在1.0 V左右促進LiF的形成。富含LiF的SEI非常薄并且具有低ASR,因為LiF具有高離子電導率和低電子電導率。
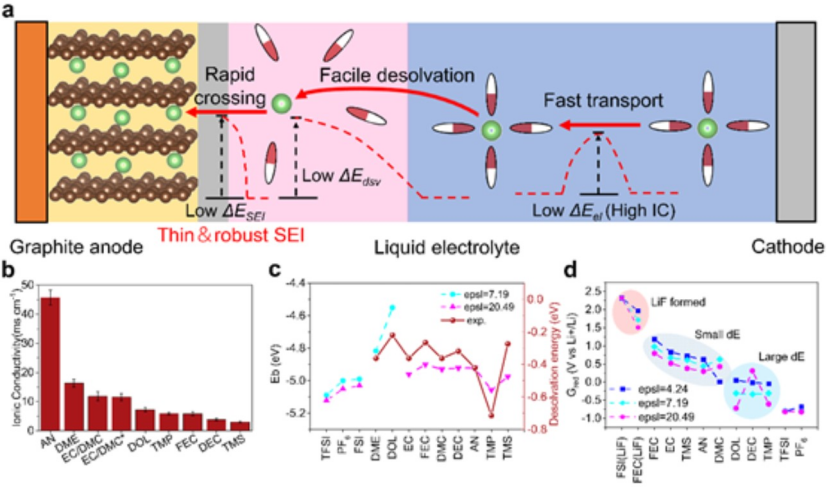
圖 1、a)石墨負極快充示意圖。b)在不同溶劑中1.0 M LiFSI的離子電導率。c)量子化學計算的結合能和測量的去溶劑化能。d)計算出的陰離子和溶劑的還原電位。
選擇LiFSI作為鹽,因為它在所鹽中具有最好的解離性,且最容易形成LiF(圖1d),而DOL具有最低的ΔEdsv(圖1c),因此作為溶劑。為了最大化倍率性能,制備了1.8 M LiFSI?DOL電解液。使用NG||Li半電池評估了不同電解質中微尺寸天然石墨(2.5NG)的倍率性能。
碳酸鹽電解液中NG從1C開始,容量快速下降,而即使在20C和50C下,1.8M LiFSI DOL電解液中的NG負極也能夠分別提供315和180 mAh g-1的容量(圖2a)。圖2b顯示,由于形成了LiCx,對于1.8 M LiFSI DOL,在1C時出現三個低于 ~0.2 V的電壓平臺。即使倍率增加到20C,電池仍有明顯的電壓平臺。
由于倍率性能是在雙電極電池中測量的,因此總過電勢由兩部分組成:石墨負極和鋰金屬電極的過電勢。石墨負極的真實過電勢(圖2c)是通過從上述充放電曲線的總過電勢中減去恒流鋰電鍍/剝離測試中的鋰金屬過電勢獲得的。當倍率從1C增加到50C時,石墨電極在1.8 M LiFSI DOL電解質中的過電勢為0.032至0.153 V,遠低于碳酸鹽電解質(從0.037至0.335 V)(圖2c)。
采用高倍率(10C)的鋰化電流進行恒流間歇滴定技術(GITT),以了解石墨電極/LiCx的鋰化/脫鋰過電位。在鋰化過程中,具有1.8 M FSI DOL電解質的電池容量大于360 mAh g-1,而具有商用碳酸鹽電解質電池的容量為80 mAh g-1(圖2d)。商用碳酸鹽電解質(142 mV)的整體電位上升幅度是1.8 M LiFSI DOL電解質(31 mV)的4.6倍。
根據Nyquist圖的擬合結果,電池電阻主要由體電阻(Rb)、表面層電阻(Rsei)和電荷轉移電阻(Rct)組成(圖2e)。1.8 M LiFSI DOL電解質中的Rsei和Rct值(9.1和4.7 Ω)遠低于碳酸鹽電解質中的值(33.2和15.1 Ω),表明1.8 M LiFSI DOL電解質中具有更快的界面反應動力學。
圖2f顯示,采用碳酸鹽電解質的NG||Li半電池在20C下只有40 mAh g-1的容量,而采用1.8 M LiFSI DOL電解質的電池具有315 mAh g-1的高可逆容量。在高電流密度下,鋰金屬電極必須每1000次循環更換一次,以消除有害影響。
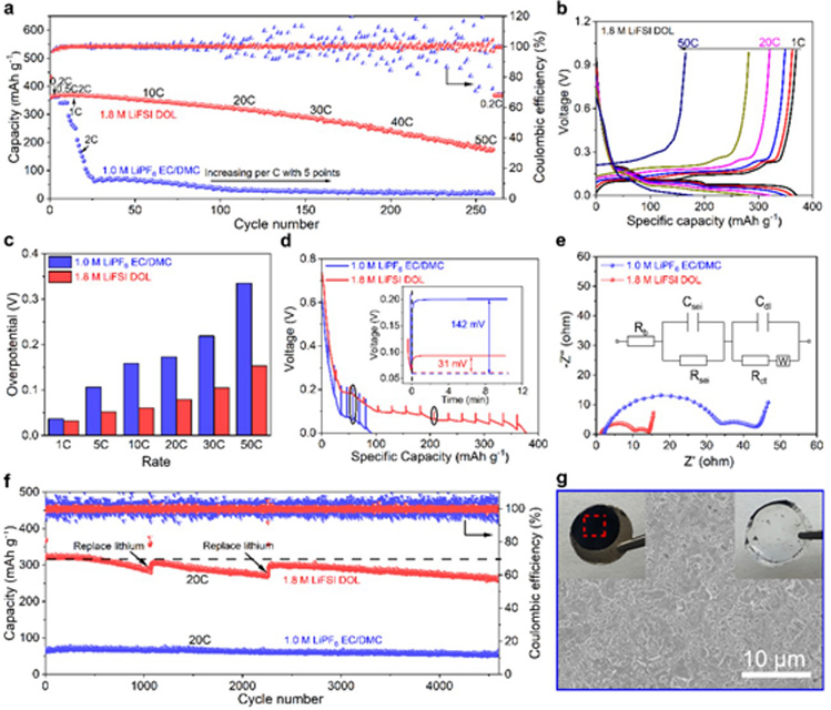
圖 2、a)具有1.8 M LiFSI DOL和1.0 M LiPF6EC/DMC(體積比為1:1)的NG||Li電池倍率性能。b)具有1.8 M LiFSI DOL的NG||Li電池充放電曲線。c)兩種電解質中不同倍率下石墨電極過電位的演變。d)在10C下,NG||Li電池通過GITT測量得到的放電電壓曲線。具有兩種電解質的NG||Li電池e)阻抗譜和f)在20C下的長循環性能。g)1100次循環后,鋰金屬電極的表面SEM圖像。
進行X射線光電子能譜(XPS)以確定循環石墨電極上的SEI化學成分。對于在碳酸鹽電解質中形成的SEI(圖3a),在C 1s光譜中檢測到有機(RCH2OLi,290.7 eV)和無機(Li2CO3,291.2 eV)成分。用Ar+濺射120秒后,SEI層的成分主要由碳物種(~80%)組成(圖3b),表明大部分SEI成分來自EC分解。
同時,濺射過程中Li2CO3和其他無機物質(O、C、P)的信號相對較弱,表明在碳酸鹽電解質中形成的SEI富含有機物。
與源自碳酸鹽電解質的SEI不同,1.8 M LiFSI DOL電解質中的NG的SEI包含更多的無機(LiO、LiF)物質(圖3c、d)。F 1s光譜中強的LiF(685.9 eV)信號和高的F含量比例證實,SEI中富含LiF。與富含有機物的SEI相比,富含LiF的SEI能夠實現更快的動力學,因為LiF具有寬的帶隙和高的化學/電化學穩定性,從而阻止副反應。
圖3e通過從頭算分子動力學(AIMD)模擬了石墨上的原子SEI結構。對于碳酸鹽電解質,可以發現開環的EC、LixPF6和Li2CO3簇,表明SEI主要是由EC溶劑的分解產生。對于1.8 M LiFSI DOL電解液,LiF和LiNxSyOz簇在界面處形成,而沒有DOL分解產物,表明LiFSI在界面處更容易分解。石墨上形成的LiF有效地阻止了電解質的連續反應,從而提高了庫侖效率。
采用低溫透射電子顯微鏡(cryo-TEM)技術,可以保留SEI的原始形貌,分析SEI薄膜的具體結構。圖3f,j顯示,對于碳酸鹽電解質,生成的SEI呈現經典的馬賽克結構,納米級Li2CO3和 Li2O 顆粒(圖3g)分散在無定形有機成分中。然而,在1.8 M LiFSI DOL電解液中生成的SEI主要的無機成分是尺寸為5-10 nm的LiF和Li2O(圖3j,k)。
與在碳酸鹽電解質中形成的厚度> 40 nm的SEI不同(圖3g),在1.8 M LiFSI DOL電解質中衍生的SEI僅為15 nm(圖3k),這有利于Li+穿過SEI進行快速傳輸。
能量色散X射線光譜(EDX)的相對含量分析表明,在1.8 M LiFSI DOL電解液中形成的界面相中無機物比在碳酸鹽電解液中形成的界面相多十倍以上(圖3l)。ADF STEM和EELS也對1.8 M LiFSI DOL電解質中形成的界面相進行了分析,結果表明元素在石墨邊緣富集(圖3m),而碳酸鹽電解質中的元素分布廣泛(圖3i)。
?
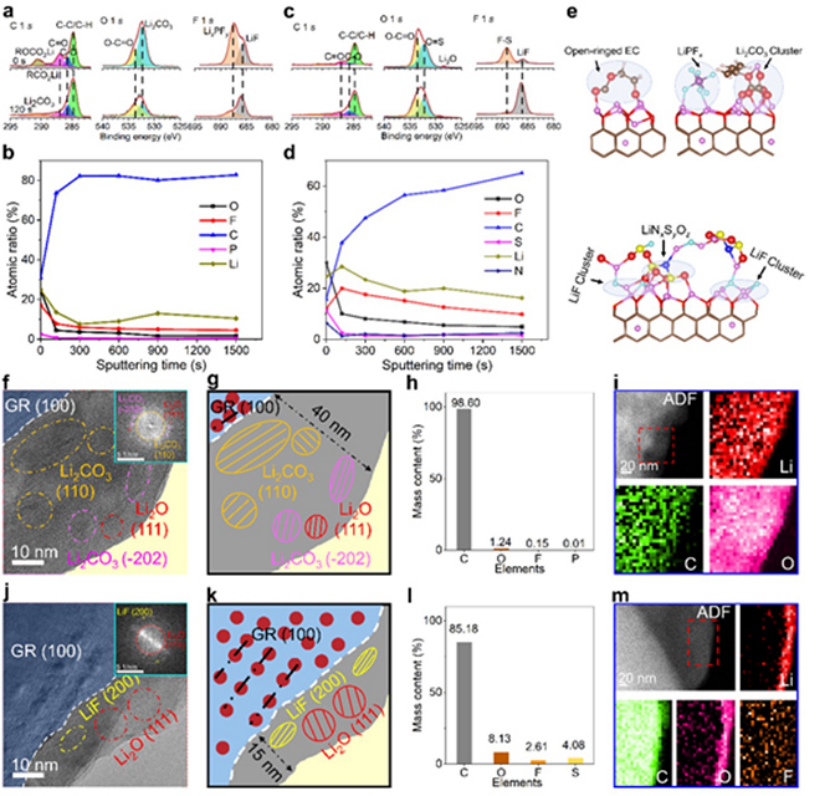
圖 3、在a)碳酸鹽電解質和b)1.8 M LiFSI DOL中,石墨電極上SEI被Ar+濺射0 s和120 s后的C 1s、O 1s和F 1s光譜。在b)碳酸鹽電解質和d)1.8 M LiFSI DOL中循環的石墨負極上SEI的元素含量。e)AIMD模擬了石墨和電解質之間的原子SEI結構。
在f)碳酸鹽電解質和j)1.8 M LiFSI DOL電解質中形成的SEI薄膜的高分辨率低溫TEM圖像。g,k)兩個高分辨率低溫TEM圖像的相應示意圖。在h)碳酸鹽電解質和l)1.8 M LiFSI DOL電解質中形成的SEI膜的不同元素含量。i)碳酸鹽電解質和m)1.8 M LiFSI DOL電解質中石墨表面的高分辨率ADF STEM和EELS結果。
使用具有高載量的微尺寸天然石墨負極和LiFePO4正極評估了1.8 M LiFSI DOL對鋰離子電池超快充電能力的影響。首先評估了在不同充電倍率下,2 mAh cm-2石墨電極的循環穩定性。在如此高的載量下,1.8 M LiFSI DOL電解質使石墨電極在4C時的容量為320 mAh g-1,在10 C時的容量為150 mAh g-1(圖4a),而碳酸鹽電解質在4C時僅為20 mAh g-1(圖4a)。
此外,還評估了電池的低溫性能。圖4b,c的低溫測試顯示,隨著溫度從25℃逐漸降低到-30 ℃,1.8 M LiFSI DOL在-30?℃下仍有300 mAh g-1的容量,而碳酸鹽電解液-30℃下幾乎沒有容量。在60C下,具有1.8 M LiFSI DOL電解質的軟包LFP||NG電池容量為60 mAh g-1,在長循環過程中沒有衰減,庫侖效率穩定為99.99%(圖4d),遠遠超過了使用碳酸鹽電解質的電池性能。
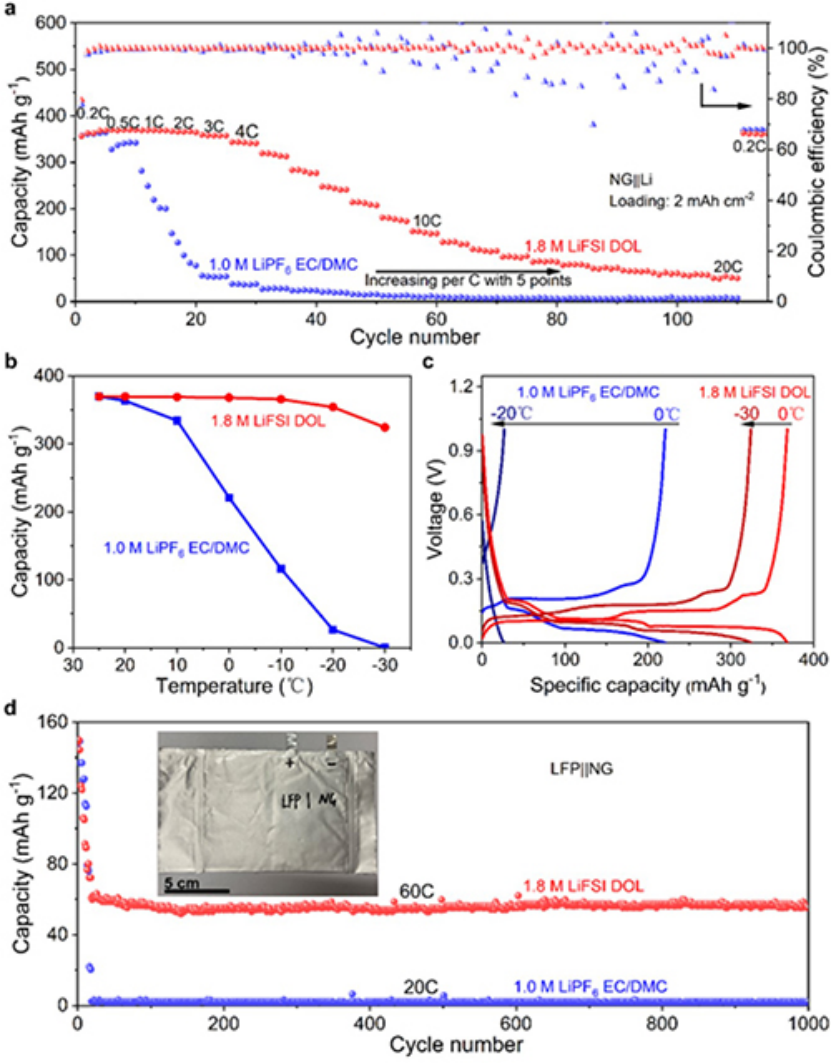
圖 4、具有兩種電解質的NG||Li電池 a)倍率性能,b)低溫性能和c)相應的充放電曲線。d)具有兩種電解質的LFP||NG軟包電池長循環性能。
為了與高壓LiNi0.8Mn0.1Co0.1O2(NCM811)正極相匹配,還配制了1.0 M LiPF6FEC/AN高壓快速充電電解質。1.0 M LiPF6?FEC/AN中具有和不具有陰離子的典型Li+溶劑化結構如圖5a、b所示。RDF結果表明,Li+的初級溶劑化結構為Li(PF6)(FEC)3AN。溶劑化殼中的FEC溶劑和PF6-陰離子傾向于在界面處被還原形成LiF,而AN溶劑加速了電解質內的鋰離子傳輸。
在20C時,1.0 M LiPF6 FEC/AN電解質使石墨電極能夠實現230 mAh g-1的高容量,優于碳酸鹽電解質(40 mAh g-1)(圖5c)。此外,具有1.0 M LiPF6/FEC:AN的NCM811||NG電池,在惡劣的循環條件下(4C充電0.3C放電)依然能夠保持170 mAh g-1的高可逆容量。
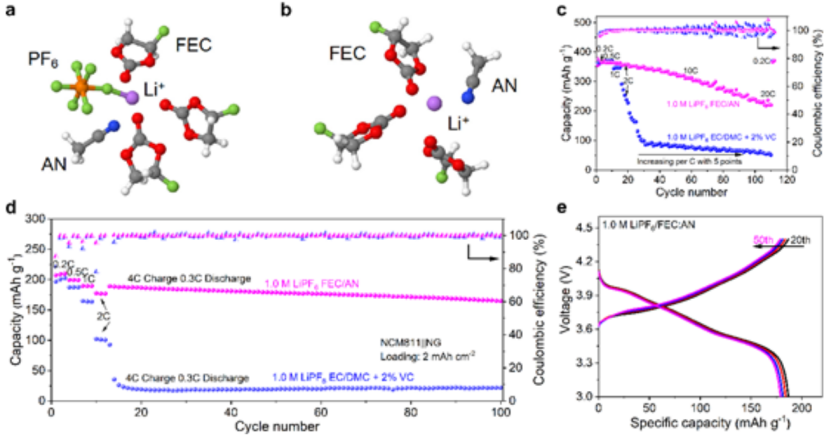
圖 5、在a)有陰離子和b)沒有陰離子情況下,1.0 M LiPF6FEC/AN電解質的典型Li+溶劑化結構。NG||Li電池的c)倍率性能、d)長循環性能,以及e)在惡劣條件下,具有1.0 M LiPF6FEC/AN的NCM811||NG電池充放電曲線。
總結與展望
極速充電的鋰電池需要對電解質進行優化,電解質的優化標準包括:低的Li+去溶劑化能,高離子電導率,以及在石墨表面形成薄而堅固的SEI。根據該標準制備了1.8 M LiFSI DOL和1.0 M LiPF6FEC/AN(體積比7:3)兩種快速充電電解質。前者使石墨電極在20C和50C時分別達到315 mAh g?1和180 mAh g?1的極高容量。
XPS和低溫TEM表征表明,石墨電極表面存在均勻且富含LiF的SEI。載量為~2 mAh cm?2的NG||Li電池在-30℃下具有320 mAh g-1的高容量。LFP||NG電池在20C時容量為80 mAh g-1,軟包電池在60C下容量為60 mAh g-1。本研究提供了一種簡單可行的電解質設計原則,有望實現石墨基鋰電池的快速充電。
審核編輯:劉清
