電解液是鋰離子電池四大主材之一,有鋰離子電池的“血液”之稱,電解液主要由有機溶劑、電解質鋰鹽及不同類型的添加劑組成。
其中有機溶劑是電解液的主體部分,鋰離子電池常用溶劑有碳酸乙烯酯(EC)、碳酸二乙酯(DEC)、碳酸二甲酯(DMC)、碳酸甲乙酯(EMC)等,其中EC與一種鏈狀碳酸酯的混合溶劑是鋰離子電池優良的電解液,如EC+DMC、EC+DEC等。
LiPF6是最常用的電解質鋰鹽,其電導率高,內阻小,充放電速度快,但對水分和HF極其敏感,極易發生反應,且不耐高溫,80℃~100℃會發生分解,生成五氟化磷和氟化鋰,而合適的添加劑可有效降低電解液中的微量水和HF,進而有效抑制LiPF6水解反應的發生,目前關于添加劑的種類研究頗多,不同廠家對電池的性能及要求有差異,所選擇的添加劑類型也會有所差異,通常添加劑的作用除了降低電解液中水分和HF的作用外,還有改善界面穩定性、高低溫性能及防過充、過放等方面的應用。
如圖1為幾種常見溶劑、添加劑和脫溶離子還原電位的計算結果【1】。
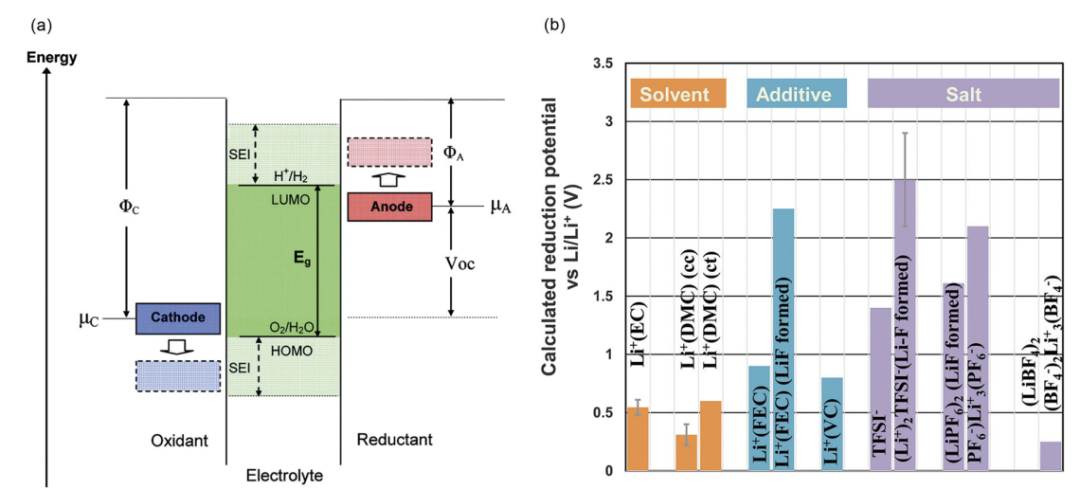
圖1 a.電解液開路能量圖示意圖;
b. 幾種常見溶劑、添加劑和脫溶離子還原電位的計算結果1
傳統碳酸酯溶劑的電化學窗口較窄、一般低于4.3V。電壓升高后,溶劑會發生分解,而且溶劑還會與高電壓狀態的正極發生副反應,致使三元材料中的過渡金屬溶出,并產生大量氣體,大幅降低電池的容量甚至安全性。對于NCM三元正極,Ni、Co、Mn的氧化態分別為+2、+3和+4價。
在充電時,鋰離子從正極脫嵌,因此Ni將由+2價轉變為+3價乃至+4價,同時正極會與電解質反應生成一層固體電解質界面(CEI層),CEI層對正極會起到保護作用,阻礙正極與電解液的進一步反應,提高正極在脫鋰狀態下的穩定性。但CEI膜的形成,也會同時造成電池阻抗增加、倍率衰減、容量衰減等問題。
因此,電解液體系對鋰離子電池產氣的影響至關重要,電池內部產氣直接增加電池使用安全風險,故電池產氣是考察電池質量和可靠性重要指標之一。現階段國內外對于鋰離子電池產氣行為的研究主要集中在正極和電解液兩個方面,而且添加劑的作用效率與正極材料的類型和組成密切相關。本文結合NCM正極對Li的半電池體系分析不同電解液體系對電池產氣行為及產氣成分的影響。
實驗設備與測試方法
1.實驗設備:型號GVM2200(IEST元能科技),測試溫度范圍20℃~85℃,支持雙通道(2個電芯)同步測試,設備外觀如圖2所示。
2.測試參數:70℃溫度條件下, 0.3C CC to 4.4V。
3.測試方法:選取不同的電解液體系(Electrolyte1&?Electrolyte2,其中Electrolyte2在Electrolyte1的基礎上加入部分添加劑)手套箱內組裝成單層疊片電芯,對電芯進行初始稱重m0,將待測電芯放入設備對應通道,開啟MISG軟件,設置各通道對應電芯編號和采樣頻率參數,軟件自動讀取體積變化量,測試溫度,電流,電壓,容量等數據。
氣體成分測試采用GC-2014C氣相色譜儀,對過充后的電芯在手套箱中取出1mL的氣體,分別使用TCD和FID兩種檢測器對不同類型的氣體濃度進行測試,可測氣體類型如圖3所示。
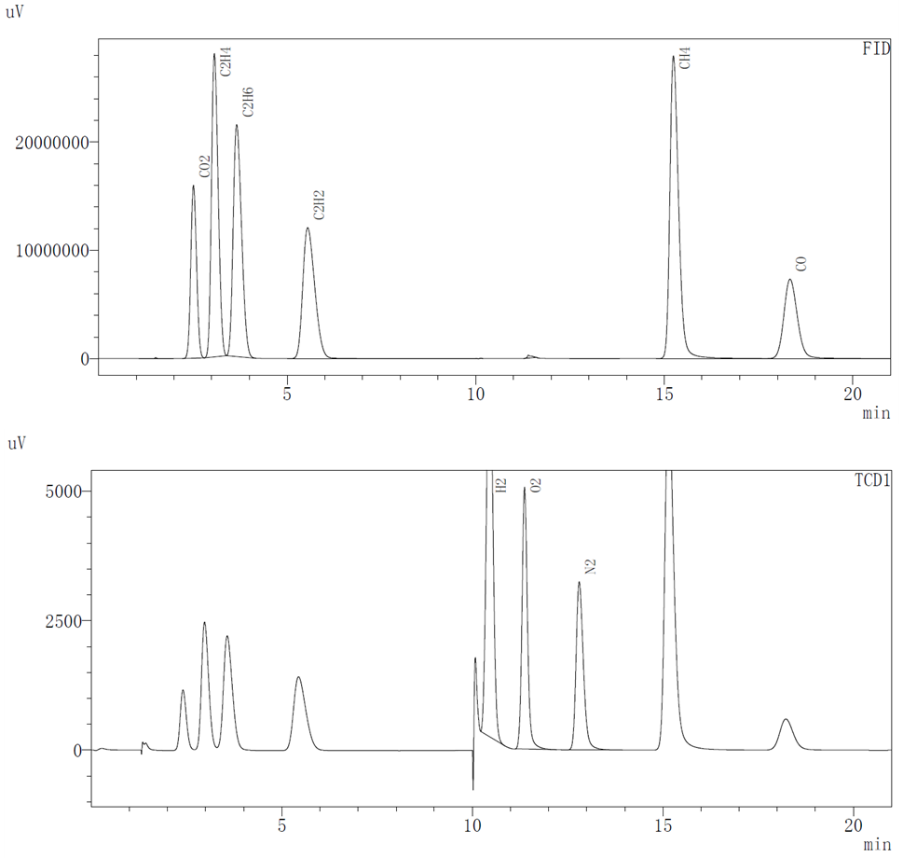
圖3. FID和TCD檢測器可測試的氣體成分
不同電解液體系原位產氣及成分分析
1.充電電壓曲線和單位體積變化曲線分析
兩種不同電解液體系電芯的電壓與單位體積變化曲線如圖4所示,從不同電解液Electrolyte1、Electrolyte2電芯曲線上可以看出,兩種電解液體系的充電電壓曲線和體積變化曲線均有明顯差異。
從單位體積變化曲線上看,Electrolyte1體系電芯整個充電階段始終保持著較高的體積變化速率,而Electrolyte2體系電芯在充電初期保持一個較低的體積變化速率,充電電壓達到4.2V左右,電芯SOC達到約80%后,體積變化速率才明顯增大,這說明Electrolyte2體系中添加劑的加入可有效降低NCM對Li電芯的單位產氣速率;
從電壓曲線上看,相比Electrolyte1體系,Electrolyte2體系電芯的充電平均電壓更低,如果忽略電芯本身組裝的差異,?Electrolyte2體系中添加劑的加入,可能使電芯NCM正極與電解液添加劑發生反應生成界面膜,阻止電解液與正極材料的持續反應,電芯的平均電壓也較低。
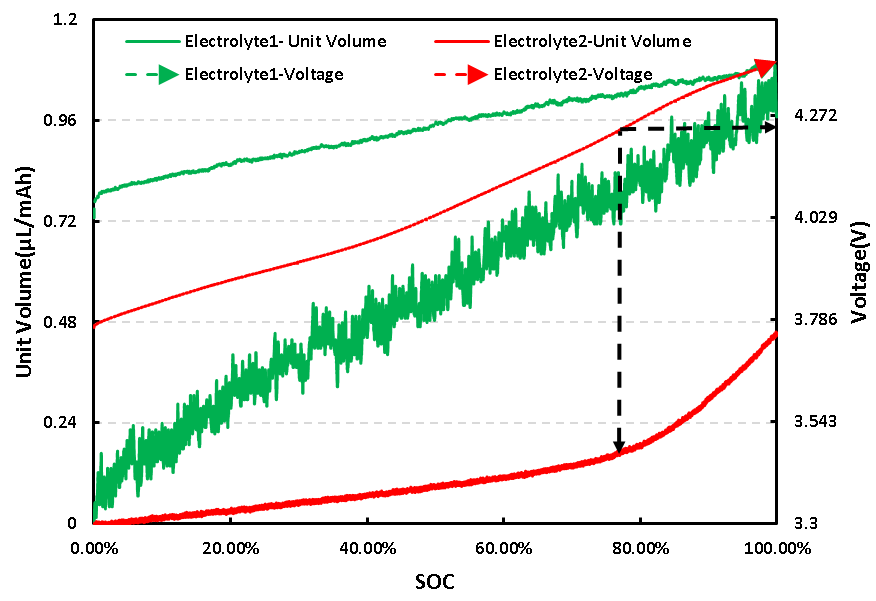
圖4. 兩種電解液體系電芯充電電壓及單位體積變化曲線
2.不同電解液體系電芯產氣成分分析
采用氣相色譜法分別對兩種電解液體系充電后的電芯進行氣相成分分析,取出1mL的氣體,采用氣相色譜進行定性分析,如圖5為不同電解液體系的產氣成分分析圖,對比分析發現,相比Electrolyte1體系,加入添加劑后的Electrolyte2體系產氣類別上CO2明顯降低,而CO明顯增多。
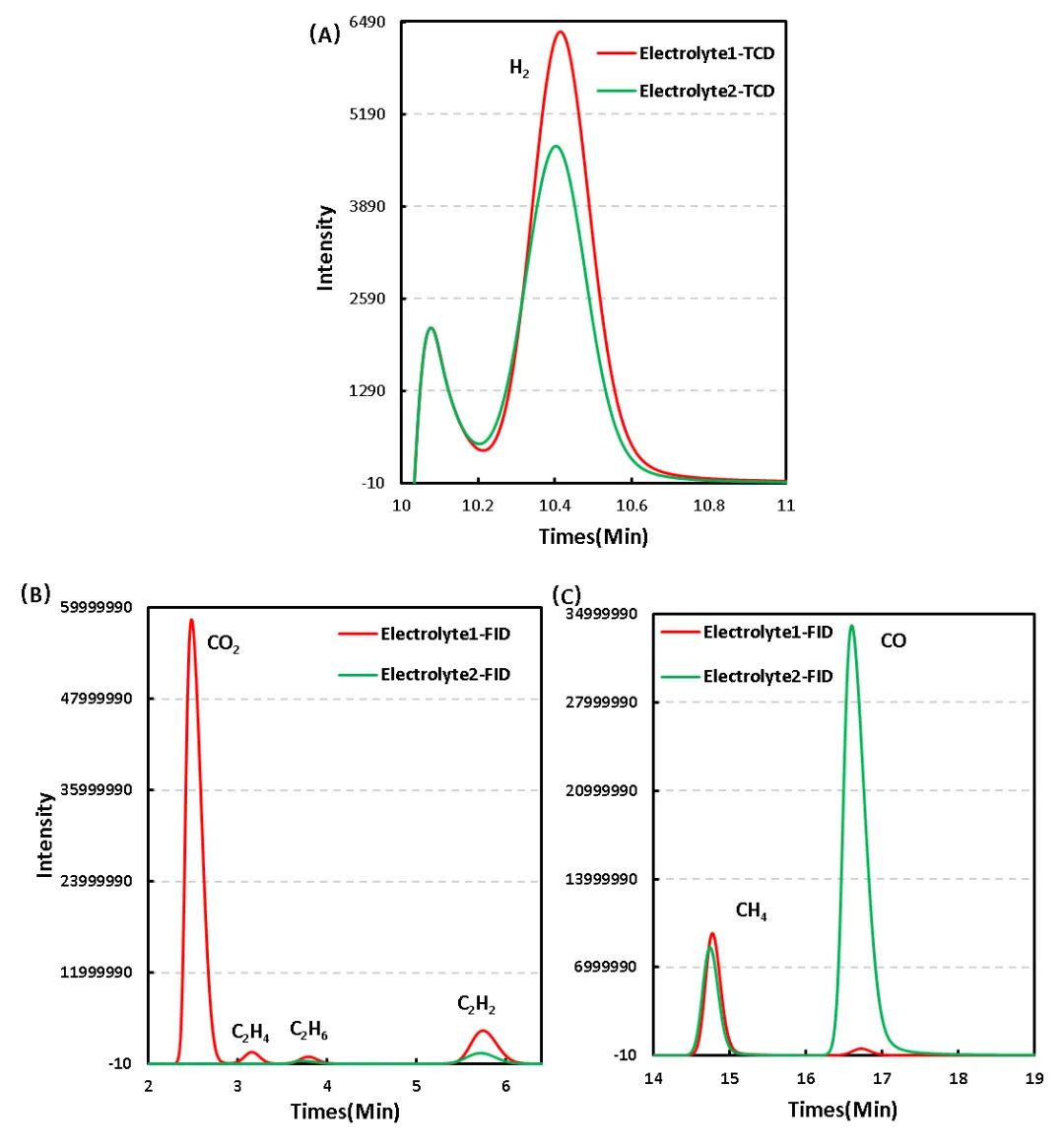
圖5. 不同電解液體系產氣成分差異:TCD&FID
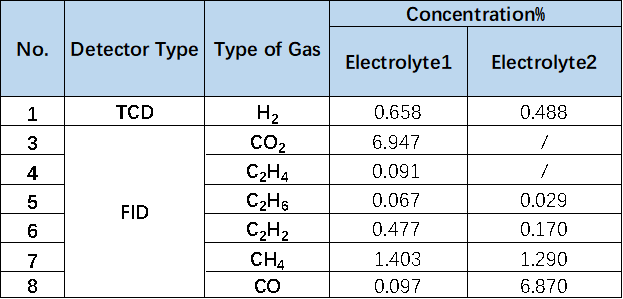
為進一步明確兩種電解液體系產氣差異,對其產氣類型及濃度進行了對比分析,如表1及圖6所示, Electrolyte1體系充電后CO2濃度為6.949%,而加入添加劑后的Electrolyte2體系CO2濃度幾乎為0。
據相關研究報道CO2是正極反應的主要氣體【2】,而正極產氣主要是正極材料與電解液的副反應產生的,一方面來自于正極表面Li2CO3的分解,另一方面電池充電到比較高的電壓時NCM材料的表面開始釋放原子氧,強氧化性的原子氧會導致電解液的氧化分解,產生CO2和CO;產生的H2主要來自于電解液中殘留的水分;這說明Electrolyte2電解液中添加劑可能是一種有效的正極成膜添加劑,可以在正極表面形成穩定的保護膜,進而有效減少正極與電解液副反應的發生,?同樣的C2H4和C2H2濃度的減少也和該體系下正極的反應變化相關聯。
CO等氣體主要是負極成膜的過程中,電解液中的EC溶劑在負極表面發生分解導致的;對于與負極反應相關的CO濃度變化,相比Electrolyte1體系CO濃度0.097%,Electrolyte2體系加入添加劑后CO的濃度增長到了6.870%,由于負極材料在電芯體系產氣反應中受溫度的影響很大,由此看來,Electrolyte2體系中添加劑的加入會降低負極的熱穩定性,加速高溫下副反應的發生。
除此之外,其它幾種類型的氣體濃度也會有不同的差異,這種差異除了電解液體系差異外,還可能與電芯組裝差異有關。
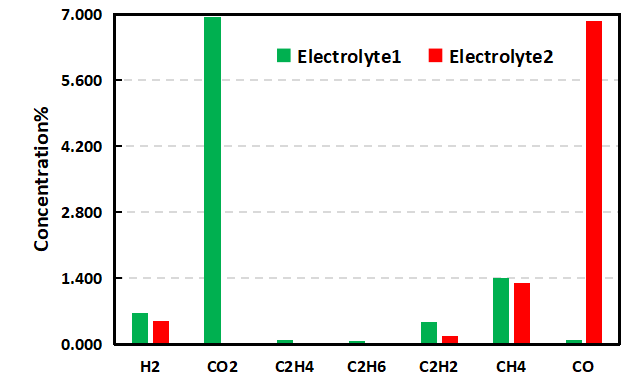
圖6. 不同電解液體系產氣類型濃度對比圖
表1. 不同電解液體系產氣類型濃度對比表格
總結
本文采用一種可控溫雙通道原位產氣體積監控儀,并結合氣相色譜,對比不同電解液體系下NCM對Li體系電池產氣行為及產氣成分差異,進一步明確了添加劑對電芯內部電化學反應的差異,同時印證了該分析系統可作為電解液配方優化及添加劑性能評估及優化篩選的有效手段。
審核編輯:劉清
