引言
能源和環境是人類進入21世紀必須面對的兩個嚴峻問題,開發新能源和清潔可再生能源是今后世界經濟中最具決定性影響的技術領域之一。鋰離子電池自問世以來發展極快,這是因為它正好滿足了移動通訊和筆記本電腦迅猛發展對電源小型化、輕量化、長工作時間、長壽命、無記憶效應和對環境無公害等的要求。而聚合物固態電解質代替液體電解質來制造聚合物鋰離子電池,則是鋰離子電池的一個重大進步,其主要優點是具有高的可靠性和加工性,可以做成全塑結構,從而使制造超薄及自由度大的電池的愿望得以實現。
1 鋰離子電池的結構特點
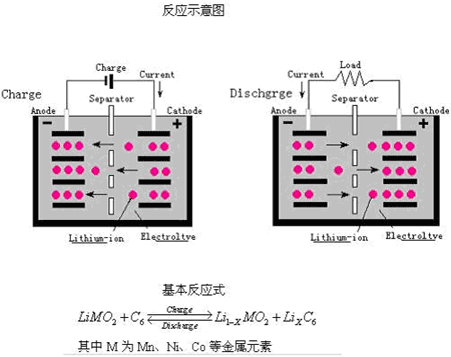
鋰離子電池的正負極活性物質均為嵌入化合物,充電時Li+從正極脫出,經過電解質插入到負極;放電時則相反,電池的充放電過程實際上是Li+在兩個電極之間來回嵌入和脫出的過程,故這種電池又稱為“搖椅電池”(Rocking Chair Batteries,縮寫為RCB)。其反應示意圖及基本反應式如下所示:
2. 聚合物鋰離子電池技術
2.1 聚合物鋰離子電池的性能特點
聚合物鋰離子電池是指電解質使用固態聚合物電解質(SPE)的鋰離子電池。電池由正極集流體、正極膜、聚合物電解質膜、負極膜、負極集流體緊壓復合成型,外包封鋁塑復合薄膜,并將其邊緣熱熔封合,得到聚合物鋰離子電池。由于電解質膜是固態,不存在漏液問題,在電池設計上自由度較大,可根據需要進行串并聯或采用雙極結構。
聚合物鋰離子電池具有以下特點:①塑形靈活性;②更高的質量比能量(3倍于MH-Ni電池);③電化學穩定窗口寬,可達5V;④完美的安全可靠性;⑤更長循環壽命,容量損失少;⑥體積利用率高;⑦廣泛的應用領域。
其工作性能指標如下:工作電壓:3.8V;比能量:130Wh/kg,246Wh/L;循環壽命:>300;自放電:<0.1%/月;工作溫度:253-328K;充電速度:1h達到80%容量;3h達到100%容量;環境因素:無毒。
2.2 正極材料
鋰離子電池的特性和價格都與它的正極材料密切相關,一般而言,正極材料應滿足:⑴在所要求的充放電電位范圍內,具有與電解質溶液的電化學相容性;⑵溫和的電極過程動力學;⑶高度可逆性;⑷全鋰狀態下在空氣中穩定性能好。隨著鋰離子電池的發展,高性能、低成本的正極材料研究工作在不斷地進行。目前,研究主要集中于鋰鈷氧化物、鋰鎳氧化物和鋰錳氧化物等鋰的過渡金屬氧化物[1](見表1)。
表1 鋰離子電池三種主要正極材料的比較
鋰鈷氧化物(LiCoO2)屬于α-NaFeO2型結構,具有二維層狀結構,適宜鋰離子的脫嵌。由于其制備工藝較為簡便、性能穩定、比容量高、循環性能好,目前商品化的鋰離子電池大都采用LiCoO2作為正極材料。其合成方法主要有高溫固相合成法和低溫固相合成法,還有草酸沉淀法、溶膠凝膠法、冷熱法、有機混合法等軟化學方法。
鋰鎳氧化物(LiNiO2)為巖鹽型結構化合物,具有良好的高溫穩定性。由于自放電率低、對電解液的要求低、不污染環境、資源相對豐富且價格適宜,是一種很有希望代替鋰鈷氧化物的正極材料。目前LiNiO2主要通過Ni(NO3)2、Ni(OH)2、NiCO3、 NiOOH和LiOH、LiNO3及LiCO3經固相反應合成。LiNiO2的合成比LiCoO2困難,其主要原因是在高溫條件下化學計量比的 LiNiO2容易分解為Li1-xNi1+xO2,過量的鎳離子處于NiO2平面之間的鋰層中,妨礙了鋰離子的擴散,將影響材料的電化學活性,同時由于 Ni3+比Co3+難得到,因此的合成必須在氧氣氣氛中進行[2]。
鋰錳氧化物是傳統正極材料的改性物,目前應用較多的是尖晶石型 LixMn2O4,它具有三維隧道結構,更適宜鋰離子的脫嵌。鋰錳氧化物原料豐富、成本低廉、無污染、耐過充性及熱安全性更好,對電池的安全保護裝置要求相對較低,被認為是最具有發展潛力的鋰離子電池正極材料。Mn溶解、Jahn-Teller效應及電解液的分解被認為是導致鋰錳氧化物為正極材料的鋰離子電池容量損失的最主要原因。
2.3 固態聚合物電解質
以離子傳導電流的固體材料通常被稱之為固體電解質,它包括晶體電解質、玻璃電解質和聚合物電解質三種類型,其中固態聚合物電解質(SPE)具有質輕、易成膜、粘彈性好等優點,可用于電池、傳感器、電致變色顯示器和電容器等方面。將SPE用于鋰離子電池,可排除液體電解質易泄漏的問題,取代電池中的隔離膜,抑制電極表面枝晶的產生,降低電解質與電極的反應活性,提高電池的比能量,使電池具有耐壓、耐沖擊、生產成本低和易于加工等優點。
常規的固態聚合物電解質(SPE)由聚合物與鋰鹽構成,它是鋰鹽溶于聚合物而形成的電解質體系。通常分子鏈上含有能與Li+發生配位作用的氧、氮、硫等極性基團的聚合物可用來形成該類體系,如:聚氧化乙烯(PEO)、聚氧化丙烯、聚氧雜環丁烷、聚乙烯亞胺、聚(N-丙基-1氮雜環丙烷)、聚硫化亞烴等。作為硬酸的Li+傾向于和硬堿發生相互作用,所以鋰鹽在含氮、硫極性基團的聚合物中的溶解度較在含氧極性基團的聚合物中小,電導率(σ)很低而沒有實際的意義;PEO分子的構象比其它聚醚分子更有利于與陽離子形成多重配位,能溶解更多的鋰鹽,表現出好的導電性能,因此PEO+鋰鹽體系就成為SPE中最早和最廣泛研究的體系。
但是常規的固態聚合物電解質(SPE)的σ室溫通常小于10-4S·cm-1,為滿足鋰離子電池的要求,在聚合物/鹽體系中加入能促進鋰鹽離解、增加體系的自由體積分數并降低其玻璃化轉變溫度(Tg)的增塑劑,可得到σ室溫大于10-3S·cm-1的凝膠SPE。增塑劑通常是高介電常數、低揮發性、對聚合物/鹽復合物具有可混性和對電極具有穩定性的有機溶劑。如碳酸乙烯酯(EC)、碳酸丙烯酯(PC)、碳酸二甲酯、N-甲基吡咯烷酮、環丁砜、γ-丁內酯等。常用的鋰鹽有LiPF6、LiN(SO2CF3)等。
運用XRD、DSC和交流阻抗等測試手段,對影響聚合物電導率的因素作了初步探討。
⑴鋰鹽濃度對電導率的影響
當鋰鹽的濃度較低時,聚合物電解質的電導率是比較低的,僅為10-8數量級。在鋰鹽濃度逐漸增大的過程中,由于載流離子濃度的增大,電導率也隨之增大;而當鹽的濃度繼續增大時,高的離子濃度導致了離子間的相互作用力增強,使載流離子的淌度減小,致使電導率下降。
⑵增塑劑濃度與Tg的關系
隨著增塑劑的增加,聚合物電解質的玻璃化轉變溫度逐漸減小,加快了聚合物電解質在室溫時的鏈段運動,因此它的導電能力也隨著增大。雖然增塑劑濃度的增加,大大提高了聚合物電解質的電導率,但同時也降低了聚合物電解質膜的自支成膜性和機械強度。若將預聚物、增塑劑和鋰鹽共混,利用光或熱引發聚合反應,通過化學鍵形成具有網狀結構的凝膠SPE,這樣得到的SPE不僅具有良好機械性能,而且抑制了聚合物結晶,提高了SPE中增塑劑的含量,可以獲得高σ的 SPE。
2.4 負極材料
鋰離子電池的容量在很大程度上取決于負極的鋰嵌入量,其負極材料應滿足如下要求:⑴鋰的脫嵌過程中電極電位變化較小,并接近金屬鋰;⑵有較高的比容量;⑶較高的充放電效率;⑷在電極材料的內部和表面Li+均具有較高的擴散速率;⑸較高的結構、化學和熱穩定性;⑹價格低廉,制備容易。目前有關鋰離子電池負極材料的研究工作主要集中在碳材料和具有特殊結構的其它金屬氧化物。
一般制備負極材料的方法如下:①在一定高溫下加熱軟碳得到高度石墨化的碳;②將具有特殊結構的交聯樹脂在高溫下分解得到硬碳;③高溫熱分解有機物和高聚物制備含氫碳。
碳負極材料要克服的困難就是容量循環衰減的問題,即由于固體電解質相界面膜(Solid electrolyte interphase,簡稱SEI)的形成造成不可逆容量損失。因此制備高純度和規整的微結構碳負極材料是發展的一個方向。
各種金屬氧化物其機理與正極材料類似,主要研究方向是獲取新型結構或復合結構的金屬氧化物。
參考文獻
[1]Venkatraman S,Subramanian V.Electrochemical Communications,2000,2:18~22.
[2]解晶瑩等.電源技術,1997,21(5):185~189.
